神经干细胞(NSCs)移植可以实现部分神经回路和功能的重建,是脊髓损伤(SCI)一种极具前景的治疗方式。然而直接移植到病变部位的NSCs存活率低,分化易失控。3D生物打印可以构建NSCs分布均匀且具有精确而又复杂的脊髓样结构的载细胞支架,有望为NCSs提供了合适的微环境并促进病变区域的细胞-支架和细胞-细胞相互作用,这对外源性NSCs在体内进行神经元再生和轴突连接意义重大。
近期,中科院苏州纳米技术与纳米仿生研究所的张智军教授团队开发了一种可用于制造载NSCs神经组织支架的3D生物打印策略。打印的支架能为NSCs的生长和神经分化提供良好的微环境、促进轴突再生、减少胶质疤痕形成以及优化神经网络的形成,最终能帮助恢复SCI模型大鼠的运动能力,实现SCI修复。相关成果
“3D bioprinted neural tissue constructs for spinal cord injury
repair”发表于Biomaterials上。
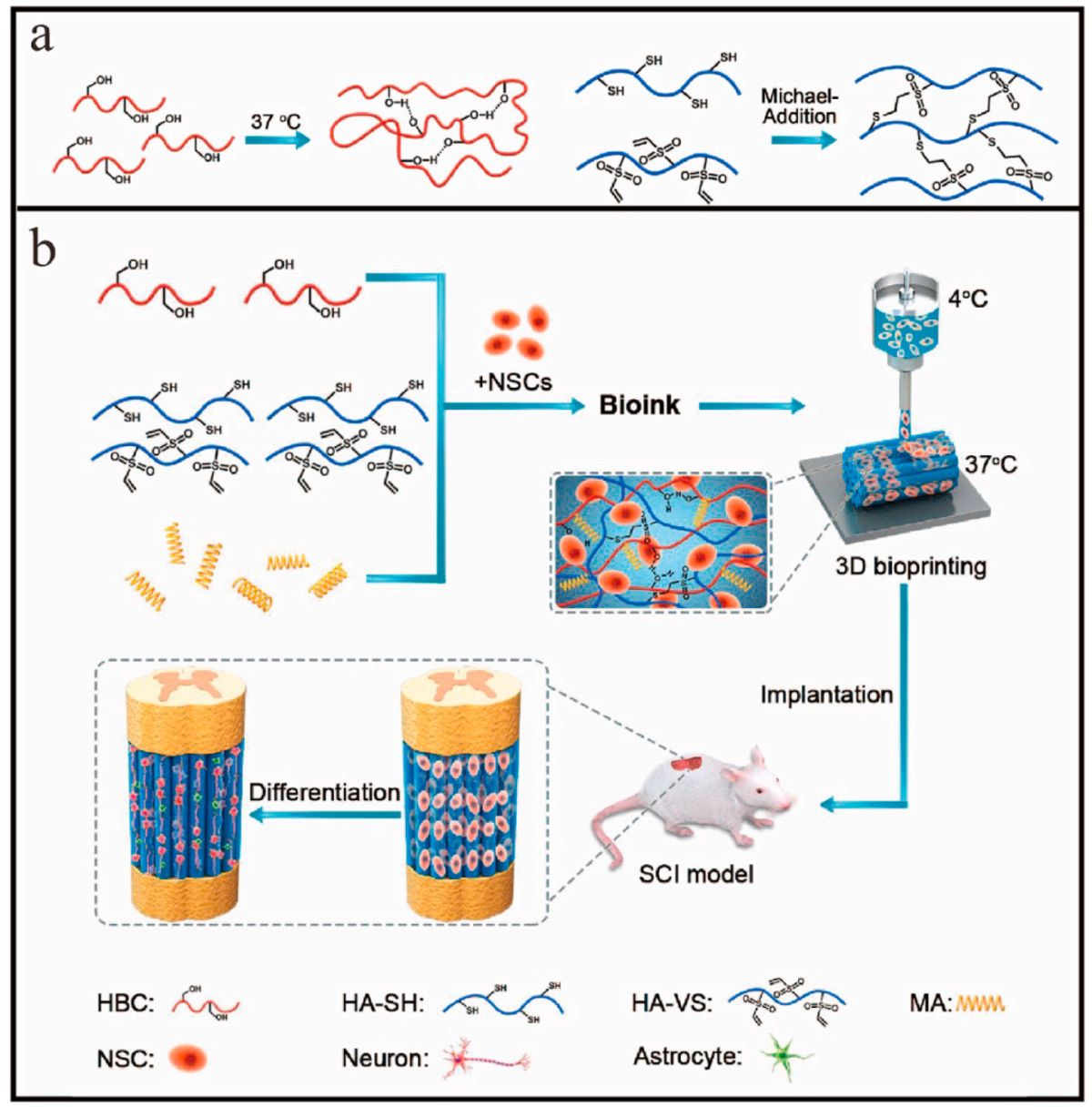
生物墨水组成:羟丙基壳聚糖(HBC)、巯基化透明质酸(HA-SH)、乙烯砜化透明质酸(HA-VS)和基质胶(matrigel ,MA)
工艺:HBC/HA-SH/MA与HA-VS溶液冰浴混匀后得到HBC/HA/MA-0.3生物墨水(HBC 3% w/v, HA-SH0.3%
w/v, HA-VS 0.3% w/v, MA 0.1% w/v) 或者BC/HA/MA-0.6生物墨水(HBC 3% w/v,
HA-SH0.6% w/v, HA-VS 0.6% w/v, MA 0.1%
w/v)。将HBC/HA/MA生物墨水置于37℃放置2h,即交联形成HBC/HA/MA水凝胶;NSCs与HBC/HA/MA生物墨水混合冰浴5min则可获得载细胞的生物墨水。
3D生物打印条件:挤出式生物3D打印法;注射器温度10℃,打印平台温度37℃,打印压力约20 kPa
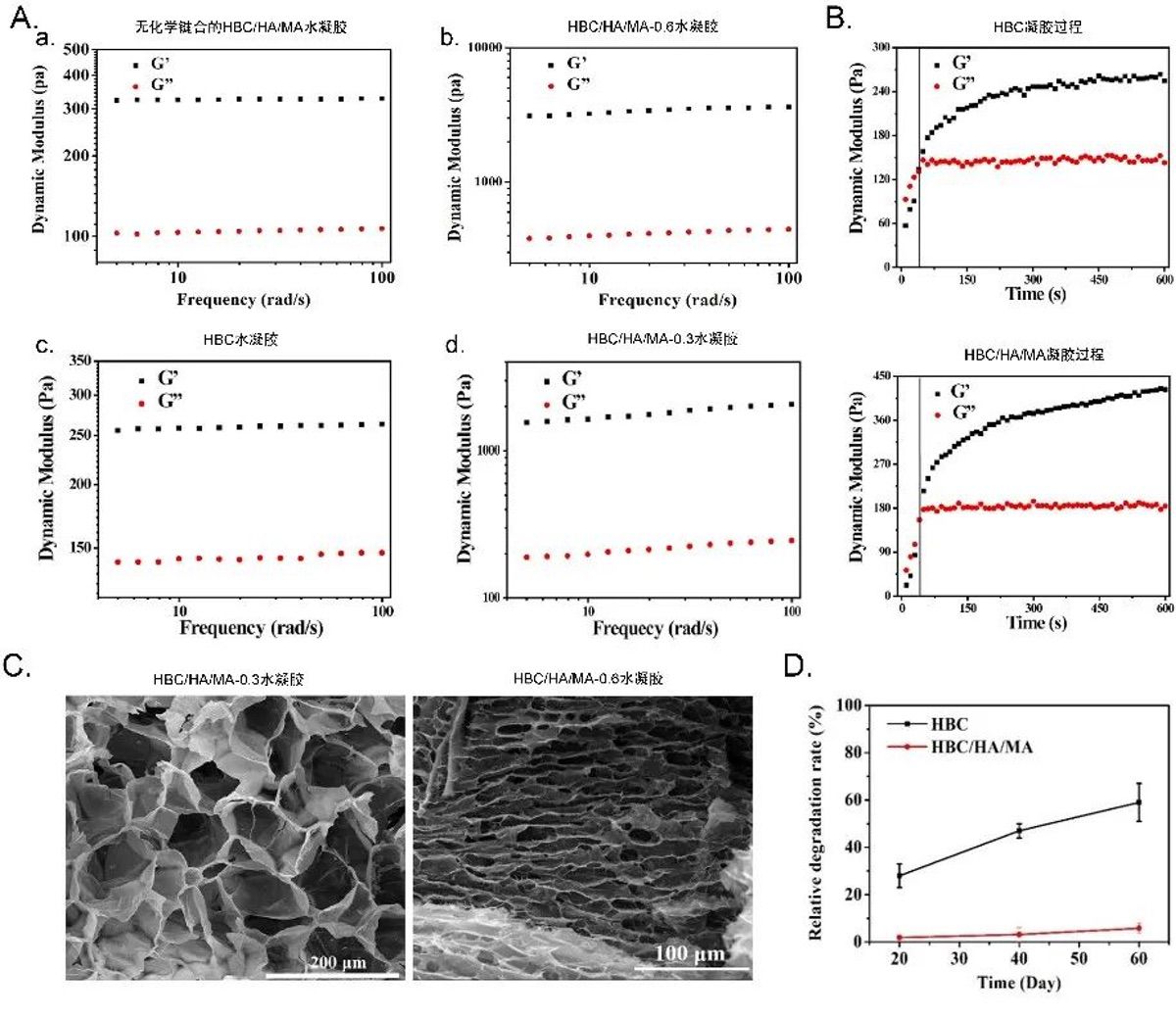
1. HBC/HA/MA生物墨水的表征
1)剪切变稀特性、凝胶速度以及机械强度表征
HBC/HA/MA生物墨水具有典型的剪切稀释行为。它在低温下具有很好的流动性,升温至37℃后则能迅速交联成水凝胶。通过对比HBC和
HBC/HA/MA的凝胶时间(弹性模量G '=损耗模量G
"时的时间),发现同浓度的HBC与HBC/HA/MA生物墨水具有相似的凝胶时间,这说明HBC在HBC/HA/MA生物墨水的快速凝胶化中起主要作用。此外,HBC/HA/MA水凝胶的机械强度明显高于HBC以及无化学键合的HBC/HA/MA水凝胶,且其机械强度在一定范围内与HA浓度呈正比(图2)。
2)溶胀率、稳定性以及形态结构表征
研究人员用扫描电子显微镜(SEM)观察了HBC/HA/MA水凝胶的形态结构,发现水凝胶内部为尺寸较均匀(约100
μm)的高孔结构,而孔隙尺寸在一定范围内会与HA浓度呈反比。他们还通过溶胀比分析以及体外降解试验观察了HBC/HA/MA水凝胶的溶胀率和降解行为。发现HBC/HA/MA水凝胶溶胀率低于HBC水凝胶,但其与细胞培养相关的平衡含水率未受显著影响。此外,交联度高的水凝胶稳定性高,不易降解(图2)。
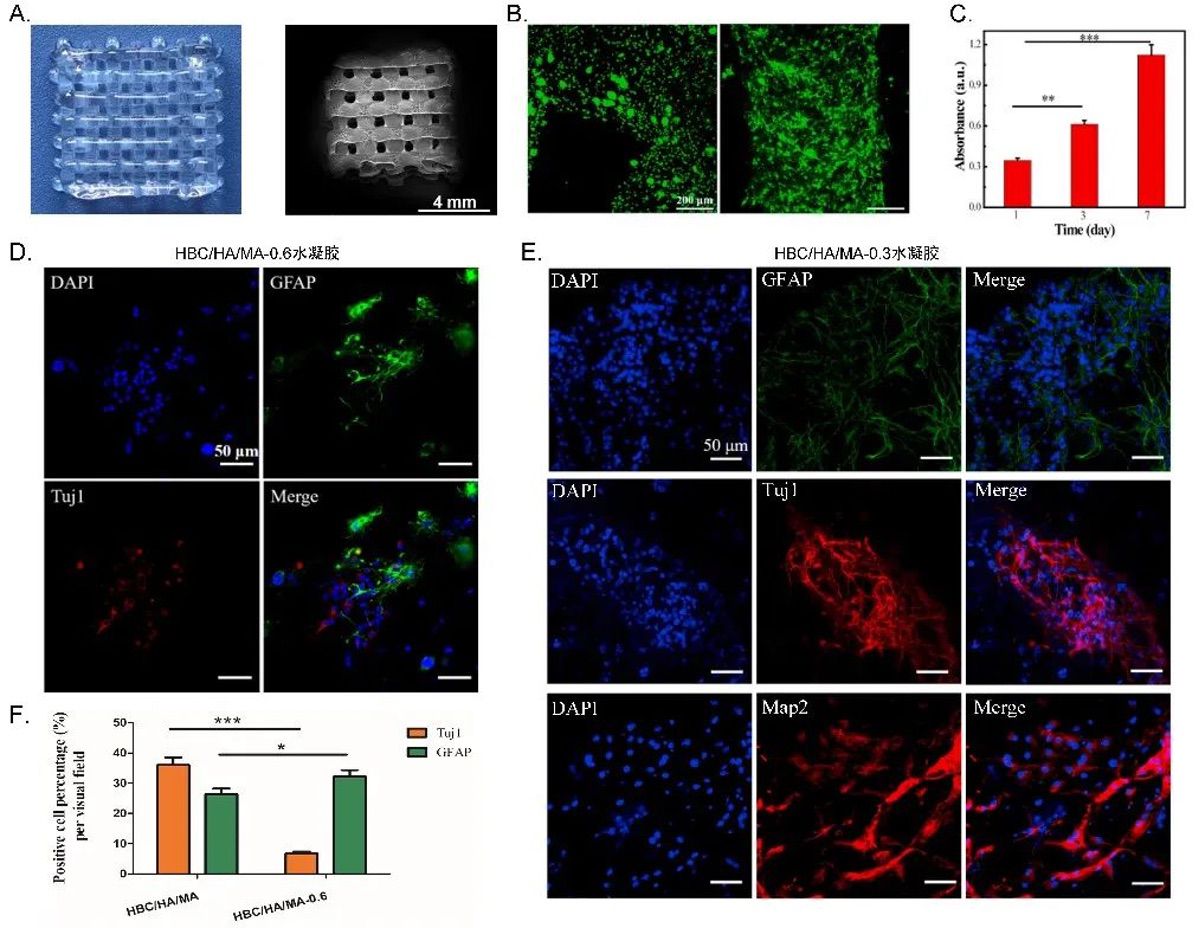
2. 载NSCs的3D打印HBC/HA/MA支架的制备与相关检测
研究者用含NSCs的HBC/HA/MA生物墨水制备了方形网格支架(打印过程中支架微观结构未见变形或坍塌)并用Live/Dead
assay评估了支架中NSCs的活力,发现其细胞活力与增殖能力较高。SEM结果也显示,粘附在支架上的NSCs在培养7
d后充分延伸,形成了富含丝状伪足的细胞间连接。他们还通过免疫荧光染色研究了生物打印后NSCs的分化能力:发现支架中的细胞表达星形胶质细胞标记物GFAP、神经元特异性细胞骨架蛋白Tuj1,并能成功分化为成熟神经元;他们还发现支架中HA的浓度对NSCs的神经元分化有重要影响,HBC/HA/MA-0.3支架中的NSCs具有较高的分化率(图3)。
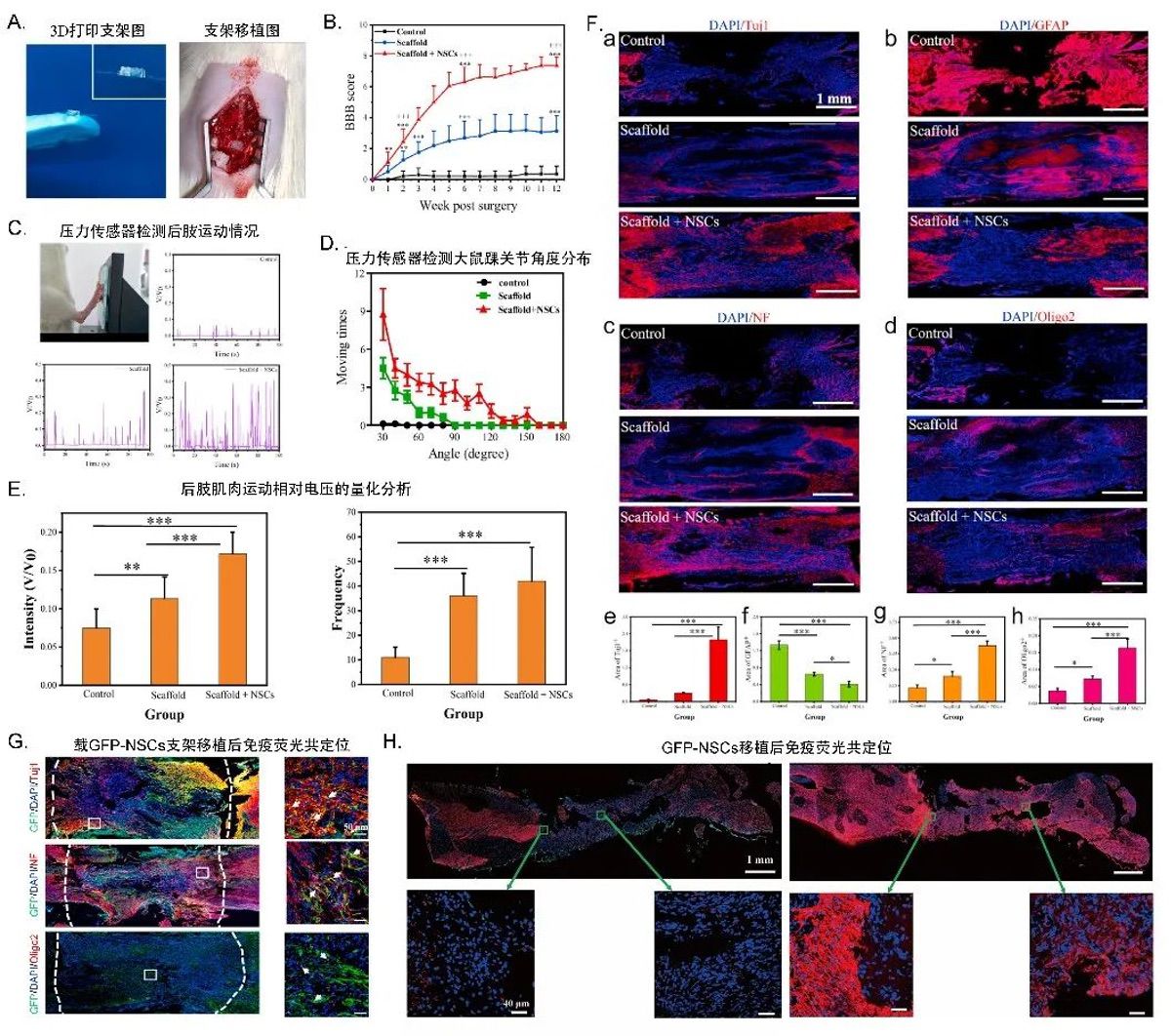
3. 3D打印的载NSCs的线性阵列样支架用于SCI大鼠治疗
1)运动功能评估
研究者打印了模拟天然脊髓白质结构的载NSCs线性阵列样支架(后面统称:载NSCs支架),然后将支架移植于T8-9脊髓完全横断的脊髓损伤模型大鼠的脊髓横断处。最后通过Basso-Beattie-Bresnahan
(BBB)试验以及柔性压力传感器实时监测手段,对载NSCs支架(治疗剂量:3×105)移植、空支架移植以及未治疗组大鼠的后肢肌肉和关节的运动情况进行了评估。发现相较于后肢未见明显运动的对照组大鼠。植入了载NSCs支架的大鼠的运动功能明显恢复,且同时出现了臀部和膝盖踝关节运动。载NSCs支架移植组修复SCI的效果优于空支架移植组和对照组(图4A-E)。
2)组织学分析
为了进一步研究载NSCs支架对SCI的治疗效果,研究者对植入支架12周后的各组小鼠的损伤脊髓进行了组织学分析,通过免疫荧光染色检测神经元、轴突以及少突胶质细胞的再生,并研究了脊髓损伤区神经纤维生长和髓鞘形成的情况。发现:载NSCs支架移植组病变区可见明显Tuj1、NF、Oligo2、GAP-43、以及髓鞘碱性蛋白(MBP)的阳性染色,而GFPA表达则较低。这表明载NSCs支架促进了损伤部位轴突和髓鞘形成、神经元的分化并抑制了胶质瘢痕的形成(图4F)。
3)植入后NSCs的存活及分化
研究者制备了载GFP-NSCs支架并将其植入病损区。然后在移植12周后取样进行免疫荧光染色来监测外源性NSCs在体内的命运。结果显示随支架移植的NSCs能存活至少12周,且GFP与大部分的Tuj1、NF、Oligo2定位一致,这提示存活的NSCs分化为了Tuj1阳性的神经元以及Oligo2阳性的少突胶质细胞。而未与GFP抗体共染的神经元和少突胶质细胞的存在则提示可能有内源性NSCs迁移至损伤区域参与损伤修复。这些结果均表明载NSCs的支架为NSCs提供了良好的微环境(图4G-H)。
4. 总结
HBC/HA/MA水凝胶具有适合NSCs生长的降解速率、孔隙率和机械强度。利用HBC/HA/MA水凝胶制备的载NSCs支架为NSCs提供了良好的微环境,支架中的NSCs存活率高,增殖能力强,具有良好的神经分化能力。载NSCs支架移植后能促进脊髓损伤区的轴突和髓鞘形成,抑制胶质瘢痕形成,明显改善SCI大鼠的运动功能。该3D生物打印的载NSCs支架有望应用于神经组织工程和其他再生医学领域。
文章来源:
https://doi.org/10.1016/j.biomaterials.2021.120771

0 留言