细胞疗法是指将细胞作为活体来替代受损组织、调节生物功能和抗击疾病,近年来,细胞疗法作为一种前景广阔的治疗策略备受关注。例如,移植人类胆道上皮细胞可治疗胆道疾病,嵌合抗原受体
T
细胞疗法可用于癌症治疗,而干细胞疗法有望在内源性组织修复方面带来益处。要充分发挥细胞疗法的治疗效果,细胞的输送途径起着重要作用,因为它们直接影响细胞的归巢、存活和旁分泌功能。全身给药是应用最广泛的细胞给药方法之一,可根据血管途径(即静脉和动脉)进一步定义。然而,由于移植细胞从血液到组织的迁移率较低,在肝、肺、脾中的滞留率较高,因此其归巢率和存活率并不令人满意,细胞功能的维持也无法保证。与全身给药相比,通过局部注射(如肌内注射、心内注射和腹膜内注射)或细胞负载支架植入手术进行局部给药理论上具有较高的给药效率,因而更具吸引力。与严重依赖细胞向损伤组织迁移能力的局部注射相比,细胞支架(CSs)移植的不确定性较小,但涉及的开放手术过程具有创伤性和临床风险,可能给患者带来痛苦和后遗症,并需要较长的恢复时间。当前,磁性微型机器人有望为基于细胞的微创疗法带来益处。然而,它们通常在磁响应性和生物医学功能之间不可避免地存在权衡。
来自哈尔滨工业大学(深圳)的金东东和来自香港中文大学的Kai Fung
Chan和张立团队合作报告了一种模块化微机器人,它由磁驱动(MA)模块和细胞支架(CS)模块组成。本研究利用3D打印技术制作了具有强磁性和 pH
响应变形能力的 MA 模块和具有细胞装载-释放功能的 CS
模块,随后,通过设计轴孔结构和定制相对尺寸来组装模块,从而在复杂环境中实现磁输送,同时不降低细胞功能。然后在目标病灶处实现按需拆卸,以方便 CS
模块的输送和 MA
模块的回收。此外,还在活体兔模型的胆管中验证了所提系统的可行性。因此,这项研究提出了一种基于模块化设计的策略,能够无损地制造多功能微机器人,并促进其在未来细胞疗法中的发展。相关工作以题为“Modularized
microrobot with lock-and-detachable modules for targeted cell delivery
in bile duct”的文章发表在2023年12月15日的国际顶级期刊《Science Advances》。

1. 创新型研究内容
本研究开发了一种模块化微机器人系统,该系统由专门的模块(即 MA 模块和 CS
模块)组成,旨在为靶向细胞递送提供多功能特性,并通过分工与合作解决不同功能之间的折衷问题(图
1)。这两个模块都是通过3D打印技术定制和制造的,并相应设计了两种水凝胶打印前体,以满足所需的功能,并实现分辨率约为 30 μm
的高精度制造。具体而言,MA 模块通过引入丰富的钕铁硼硬磁掺杂剂和悬垂羧基分子基团,分别具有强磁响应性和 pH 触发变形性,而 CS
模块则具有良好的生物相容性和生物降解性,可用于细胞的装载和释放。通过设计模块的轴孔结构、定制模块的相对尺寸以及调节环境 pH 值,MA 和 CS
模块能够以可控的方式组装成多功能模块化微机器人。
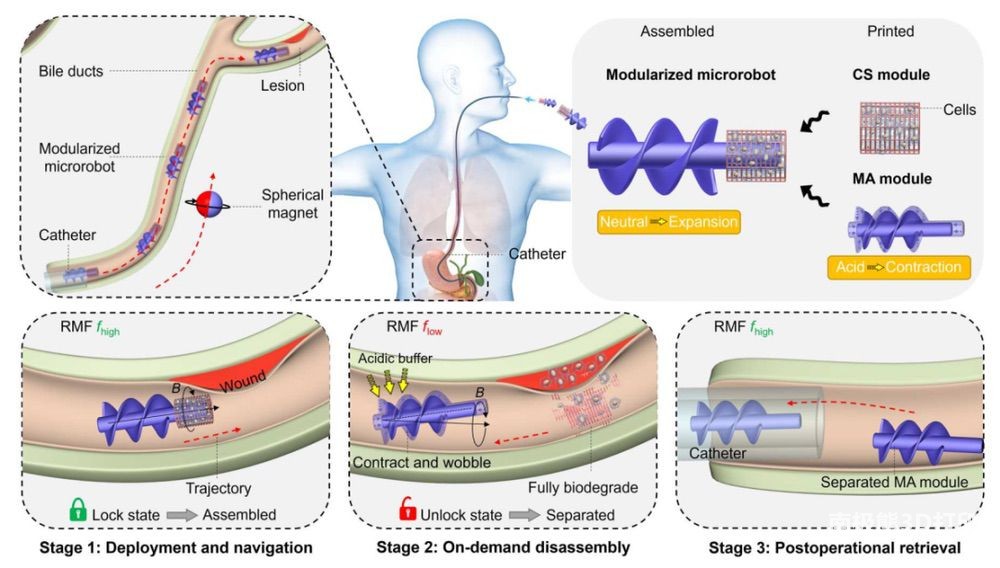
本研究以胆管(BD)中的细胞输送作为概念验证,首先通过导管将获得的微型机器人部署到目标病灶附近,然后在旋转磁场的驱动下在狭窄曲折的管道中进行稳健输送,这是传统介入导管术难以达到的(第一阶段)。模块的稳健组装得到了全程保证,以便通过
MA 模块的螺旋推进,在粘性和流动环境中顺利运输 CS 模块。一旦微型机器人到达存在酸性环境的目标部位,其组装状态将通过 MA 模块的 pH
响应收缩解除锁定,然后额外引入低频旋转磁场,使可生物降解的 CS 模块脱离,以进行细胞治疗(第 2 阶段)。在最后阶段,分离的 MA
模块被输送回导管并进一步回收,从而将潜在的安全风险和长期副作用降至最低。在X射线透视或超声(US)成像系统的实时引导下,包括磁输送、按需拆卸和术后回收微型机器人在内的整个过程在猪体外BD和兔体内BD中得到了进一步的成功验证。因此,在模块化设计原理的基础上,本研究提出了一种同时赋予微机器人卓越的MA能力和细胞功能而不损害它们的策略,这可能对未来开发基于细胞的无创靶向治疗BD疾病大有裨益。
【设计、制造和鉴定专用模块】
为了同时实现令人满意的驱动和生物功能,本研究对模块的组件和结构进行了精心设计。如前所述,模块化微机器人系统由两个模块组成(图
2A),即具有主动移动性的轴状 MA 模块和具有生物相容性和生物降解性的孔状 CS
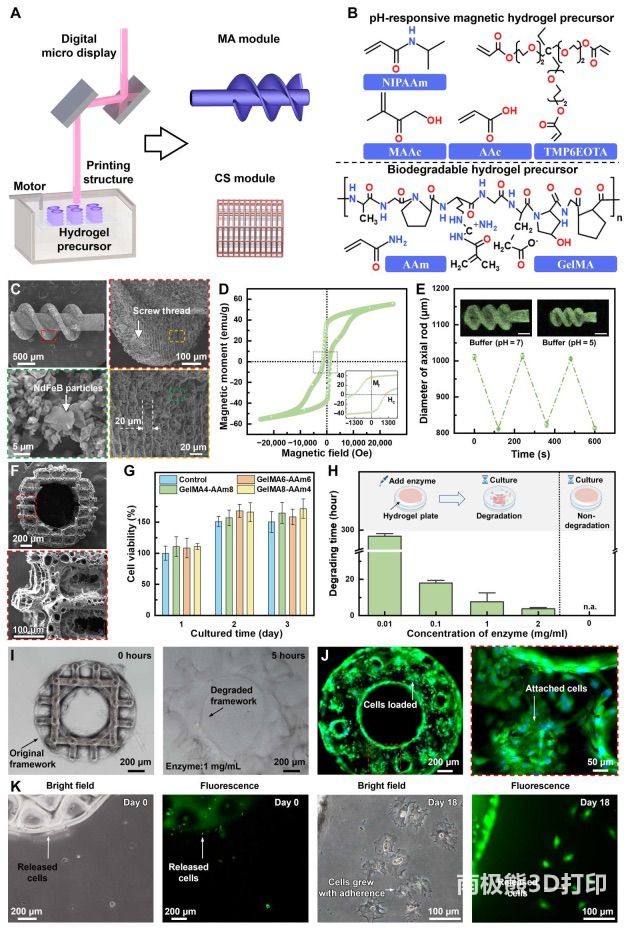
模块,前者充当发动机,后者用于携带细胞。本研究利用基于投影微立体光刻技术的3D打印技术制造模块,这种技术使我们能够以高分辨率定制复杂的亚毫米结构。本研究开发了两种水凝胶前体,即
pH 响应磁性水凝胶前体和可生物降解水凝胶前体,分别满足 MA 和 CS 模块的需求(图 2B)。pH 响应磁性水凝胶前体由丙烯酸
(AAc)、甲基丙烯酸 (MAAc)、N-异丙基丙烯酰胺 (NIPAAM)、乙氧基化三羟甲基丙烷三丙烯酸酯 (TMP6EOTA)、聚乙烯吡咯烷酮
(PVP)、苯基双(2,4,6-三甲基苯甲酰基)氧化膦 (Irgacure 819) 和钕铁硼微粒组成。在印刷过程中,光引发剂
Irgacure 819 在紫外线照射下被激发产生自由基,从而引发交联剂 TMP6EOTA 和单体 AAc、MAAc 以及 NIPAAM
之间的聚合反应,进而构成水凝胶框架。由于从 AAc 和 MAAc 中引入了阴离子悬垂(羧基)基团,制备的水凝胶具有 pH 响应特性。当环境的
pH 值高于它们的酸解离常数(pKa)时,羧基就会电离,相互之间产生静电斥力,导致水凝胶发生膨胀行为。本研究通过扫描电子显微镜(SEM)评估了
pH 响应磁性水凝胶前体的 3D 打印性能,如图 2C 所示。图 2C 可以清楚地观察到制作的 MA
模块的结构,包括轴杆和螺纹,这与设计的形态一致。这些结构证明了 pH 响应水凝胶前体 3D 打印的保真度和精度,分辨率高达 30 μm。
【利用专用模块按需组装和拆卸模块化微型机器人】
在实现了不同专业功能模块的制造之后,本研究关注了模块的按需组装和拆卸。本研究设计了MA模块和CS模块相应的轴状和孔状形状,将这两个模块整合为一个模块化微机器人系统(图3A)。细胞首先通过
GelMA 的精氨酸-甘氨酸-天冬氨酸(RGD)基团与细胞上的整合素受体相互作用,粘附并扩散到 CS
模块上,这在生物学上是稳定和安全的。然后,可定制孔形状的 CS 模块可与轴状 MA
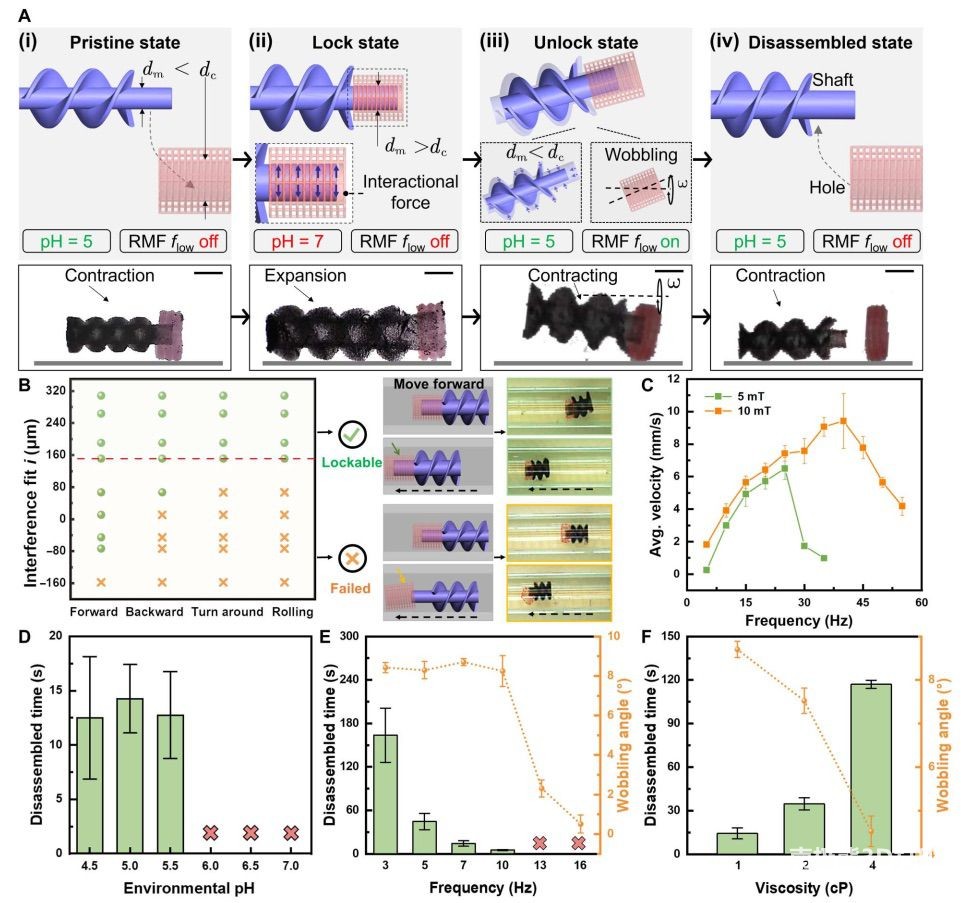
模块机械固定,形成模块化微机器人。这种细胞装载策略不仅有利于大量装载细胞,提高细胞治疗的运输效率,还能最大限度地减少输送细胞的意外损失。模块化微机器人系统中模块的组装和拆卸都是可控的。具体来说,在3D打印后,首先用酸性缓冲液处理
MA 模块,使其体积收缩,便于将其插入 CS 模块的孔中。在本研究中,CS 模块的孔的内径固定为 850 μm(dc),而轴状 MA
模块的轴杆在中性环境下的尺寸从 650 μm 到 1150 μm(dm)不等。因此,两个模块之间存在不同的干涉配合,即 i = dm -
dc(从 -200 μm 到 300 μm),可用于调节 MA 和 CS 模块之间的锁定强度。如图 3B 所示,在依次将 MA 模块收缩、插入
CS 模块并膨胀后,微机器人运动模式的改变,包括前进、后退、掉头和滚动,都会改变模块化微机器人的装配状态,这取决于 i 的值,可以发现 i
存在一个临界值(即 160 μm,图 3B 中的红色虚线),在此临界值之上,无论运动模式如何,都能保证 MA 模块和 CS
模块之间的牢固锁定(绿点区域)。相比之下,当 i 小于 160 μm 时,MA 模块很容易与 CS
模块分离(红色交叉区域),尤其是在回转和滚动运动中,从而导致微机器人组装失败。因此,这些结果为微型机器人模块的尺寸设计提供了指导。在接下来的实验中,CS
模块的内径和 MA 模块的轴杆直径(中性环境下)分别设计为 850 微米和 1050
微米,这使得模块化微机器人的集成易于实现,并且在微机器人驱动过程中装配稳固。在锁定 MA 和 CS
模块后,本研究关注了模块化微机器人在不同旋转频率、粘性环境和模拟 BD 内生物条件的流动液体中的 MA 性能。首先,本研究在环境 pH 值为
7.0 的柠檬酸钠缓冲液中研究了旋转磁场频率对微机器人运动性能的影响(图 3C)。在 5 mT 的磁场强度下,将旋转频率从 5 Hz 提高到
25 Hz 可加快微机器人的平均平移运动速度,最大速度可达 6.5 mm/s。但值得注意的是,将旋转频率进一步提高到 30 Hz
会使微机器人失去与旋转磁场的同步性(即”跳出”现象),从而导致速度下降。
【在解剖 BD 模型中对模块化微型机器人的定向输送、按需释放和安全回收进行体外验证】
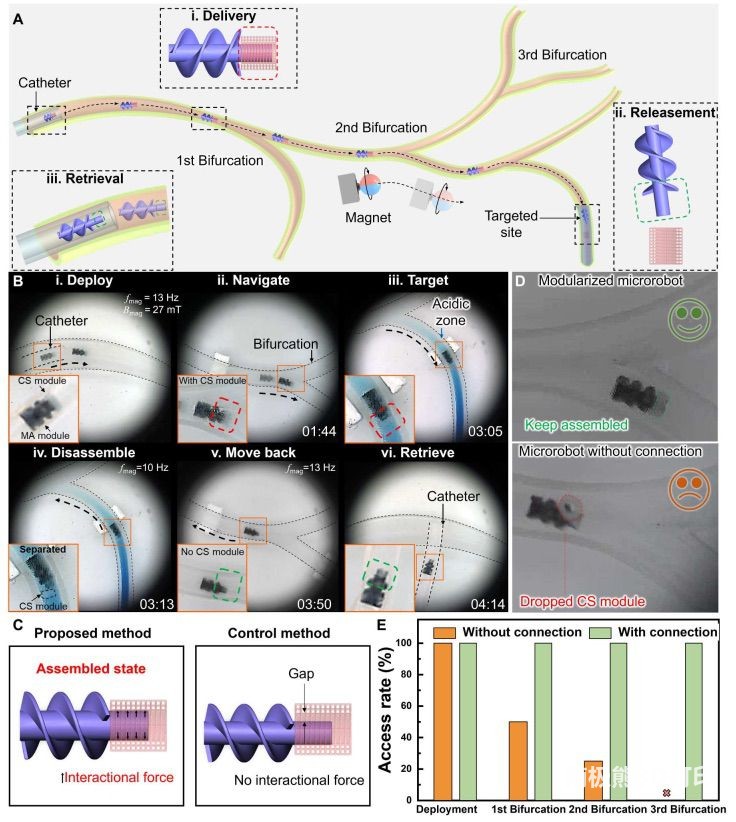
为了验证所开发的模块化微型机器人系统,本研究首先在充满无菌生理盐水的模拟 BD 模型中评估了其驱动和运动性能(图
4A)。模块化微型机器人首先通过一根灵活的医用导管(内径 2 毫米)注入 BD 模型。在频率为 13 Hz、最大磁场强度为 27 mT
的外部旋转磁场的驱动下,微机器人在模拟管道中表现出有效的螺旋运动。通过精心控制旋转球形磁铁的位置和姿态,模块化微机器人可以精确地输送到 BD
模型的任意分支,包括肝 BD(左侧和右侧)和囊性
BD。在初步进入胆囊管后,微机器人被磁力引导回到分叉前的位置,随后推进到其他分支,分叉角度达到57.2°,内径从2.8毫米缩小到1.7毫米。因此,可以得出结论,所开发的模块化微型机器人系统能够在复杂的模拟胆道中灵巧运动和选择性输送。接下来,为了系统地研究模块化微机器人系统的输送能力,本研究通过将位于最远分支的左肝管定义为目标病灶,演示了包括目标输送、按需释放
CS 模块和精确回收 MA 模块在内的完整过程(图 4A)。如蓝色区域所示,BD 模型中设计的靶点处的 pH 值设定为 5。图 4B(i 至
vi)展示了具有代表性的实验结果。模块化微型机器人最初通过导管部署在管道的起点(i),然后根据 MA
模块对外部磁场的强磁响应,在狭窄的管道中穿过三个分叉(ii)。在通过一个 90° 拐角后,微机器人在 3
分钟内成功进入目标分支(iii)。此时,环境 pH 值变为 5,促使 MA 模块体积收缩,解除了模块化微机器人的组装状态。同时施加频率相对较低的
10 Hz、强度为 27 mT 的磁场来驱动微机器人摆动,最终使 CS
模块与微机器人分离(iv)。这样的拆卸过程成功地将装载细胞的功能模块送到了目标位置,用时约 10
秒,表明本研究的酸-磁刺激-组合分离策略是有效的。最后,将单个 MA 模块移回初始部署位置并用导管收回,分别如图 4B、v 和 vi
所示,这有助于将磁性材料的潜在副作用降至最低。
为了进一步揭示本研究提出的系统的优势,本研究使用一个由非交互模块组成的微机器人系统进行了对照实验。为此,本研究将干扰拟合值 i 设为 -110
μm,这样当 MA 模块浸入中性缓冲液时,就无法通过相互作用力将其锁定在 CS 模块内部(图 4C)。此时,CS
模块的运输只能在向前运动时实现,因为向后运动会导致 CS 模块掉落,这与上文提到的模块化微机器人形成了鲜明对比。图 4D展示了两种微机器人在
BD
模型中穿越分叉点时的代表性实验结果。结果表明,模块化的微型机器人系统在进行后退运动以微调其位置后,仍能保持装配状态并成功运送CS模块,而没有联锁连接的微型机器人则未能将货物运送过分叉口。本研究还进行了定量分析,通过计算CS模块进入四个预先设计的位置(包括部署位置和三个远端分叉点)的比率来比较它们的运送效率。如图
4E 所示,所有模块化微型机器人组都成功地将 CS 模块送到了 BD
模型的指定位置。相比之下,随着微机器人依次通过分叉点,对照组的进入率明显下降(第一个和第二个分叉点的进入率分别为 50%和 25%),没有一个
CS 模块能被送到最远的一个分叉点。因此,通过相互作用的 MA 和 CS
模块之间的专业化和合作,本研究的模块化系统不仅能够在曲折、多分支和狭窄的管腔中进行稳健的运动、有针对性的输送和安全的回收,还能防止药物在输送过程中过早丢失。
【模块化微型机器人在医学成像模式引导下在体外 BD 组织中的演示】
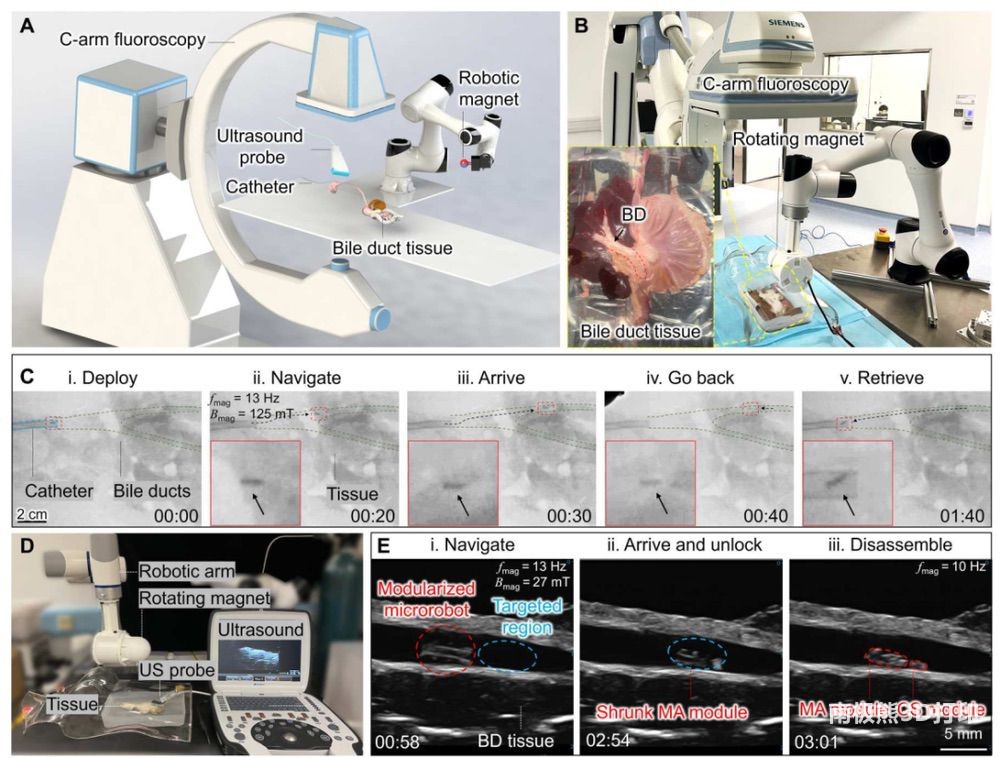
本研究对模块化微型机器人系统在活体猪 BD
中的可行性进行了评估。胆总管是连接十二指肠、脾脏、胆囊和肝脏的重要通道,因此被用作概念验证。当胆管受到损伤时,一般会采用导管辅助介入疗法,通过细胞再生医学来修复和愈合伤口。然而,狭窄的通道和多个分叉严重限制了导管在远端胆管的输送和定向进入,从而给有效、安全的细胞治疗带来了显著的挑战。本研究开发了一种基于模块化微型机器人的成像引导平台,以进入传统技术难以到达的区域,实现
BD 内的微创细胞输送。如图 5A所示,除了活体猪 BD
被放置在一个人造模型内以保持安全工作距离和防止意外碰撞外,该平台主要由三部分组成,即前面所述的模块化微机器人系统、临床成像设备(X 射线透视和
US 成像)以及将旋转球形磁铁集成在六轴机械臂上的磁力控制系统。为了观察模块化微机器人在组织内的运动情况,本研究首先使用了诊断 BD
扩张的常用技术 X 射线透视来实时监测微机器人的状况(图 5B)。管腔内填充了造影剂(水合二苯甲酸钠溶液),以便在 X 射线下对 BD
进行成像。从实验透视图像(图 5C)中,可以清晰地从周围组织中分辨出 BD 的路径和分支方向,这将为微机器人系统的定向输送提供全局环境信息。猪
BD 的内径从 2 毫米到 10 毫米不等,存在一个角度约为 34°的分叉。在本研究的实验中,模块化微型机器人首先在导管(i)的辅助下部署到普通
BD 中。由于嵌入的钕铁硼磁性颗粒具有不透射线的特性,微机器人的 MA 模块可以从背景对比中识别出来(ii),从而实现在生物组织内的 X
射线引导输送。然后,通过调节机械臂的位置和姿势,微机器人系统被磁力引导到以下分叉点,并推进到导管难以到达的肝管末端(iii)。微机器人在约10厘米长的距离内航行大约需要1分钟,这表明模块化微机器人的运动效率很高。此外,通过磁力引导微机器人回到导管(iv)附近并随后在
1 分钟内进入导管(v),也证明了可回收过程。这些结果验证了利用所开发的微机器人平台在 BD
真实管腔中对模块化微机器人进行实时运动控制和跟踪的可行性。
【利用兔 BD 模型对模块化微型机器人进行体内验证】
在猪 BD 体外的研究结果表明,本研究的模块化微型机器人能够通过磁场进行可控输送和拆卸,并且在 X 射线和 US
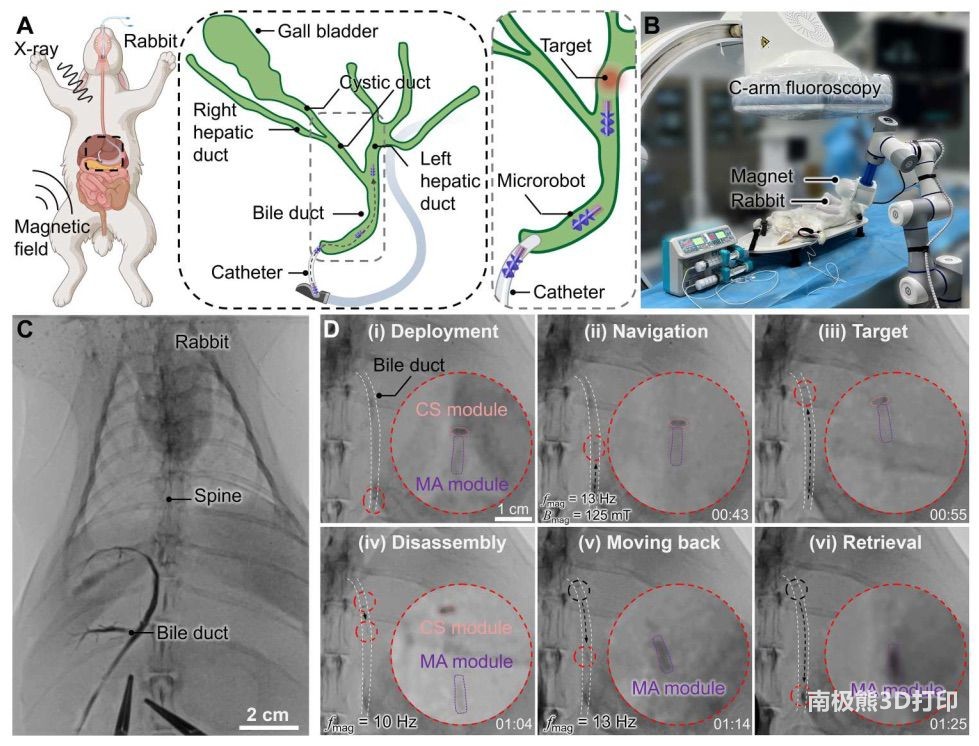
成像的实时跟踪下清晰可见。然而,这种评估方法并没有充分考虑临床经验、结果和风险。为了进一步验证本研究提出的系统在真实场景下的性能,本研究使用兔子模型进行了体内动物试验(图
6A 和 B)。实验前,通过 6 英尺导管注入造影剂,获得了兔子 BD 的 X 射线图像(图
6C),从而可以详细查看导管结构。模块化微型机器人的目标位置选择在总 BD 远端,该处表现出循环蠕动并含有流动的胆汁。往复运动周期约为 3
秒,胆汁在总胆管中的平均流速约为 83 μl/min。在实验过程中,模块化微型机器人通过导管(内径 1.8 毫米)部署在 BD
的入口处,并通过磁力输送到目标位置,然后根据需要选择性地释放 CS 模块,最后收回 MA 模块(图 6C,i 至 vi)。整个过程由 X
射线透视技术监控。与之前的体内外实验结果类似,尽管受到兔子身体的干扰,但由于嵌入的磁性颗粒,MA 模块可以在 X 射线图像中被识别出来。
2. 总结与展望
为了解决磁性微型机器人在生物医学应用中的驱动和生物功能之间的折衷问题,受模块化机器人技术的启发,本研究设计了一种模块化微型机器人系统,该系统具有异构、专用和可锁定拆卸的模块。该系统在以下方面显示出巨大优势。首先,得益于模块化设计策略,MA
模块中的钕铁硼磁粉含量可高达约 33 wt %,从而在不影响其余 CS
模块的细胞负载能力和生物降解性的情况下,获得强磁特性。其次,模块化微机器人装配牢固,在粘度高达 12 cP、平均流速为 5 cm/s
的流体中仍能发挥作用,从而能在复杂多变的环境中进行有效的磁输送输送。第三,所开发的拆卸策略可在进入目标区域后的数十秒内拆分模块,不仅可回收磁性部件,最大限度地降低对人体的潜在安全风险,还有利于缩短操作时间,防止生物医学部件过早脱落。最后,模块化微型机器人的输送和拆卸过程与医院现有的医学成像模式兼容,从而为未来的实际应用奠定了基础。
文章来源:https://www.science.org/doi/10.1126/sciadv.adj0883



0 留言