任何组织工程支架的康复能力主要取决于以下三方面:(i) 生物力学特性,如机械特性和结构;(ii) 化学特性,如细胞因子表达调控;(iii)
细胞反应调控(包括细胞招募和分化)。植入物越接近原生组织,就越能修复其中的损伤。在现有的制造技术中,只有3D生物打印(3DBP)能令人满意地复制宿主组织固有的异质性。然而,3D生物打印支架通常具有较差的机械性能,因此,近年来人们对开发承重3D生物打印骨科支架的研究兴趣日益浓厚。通常情况下,这些支架涉及多材料3D打印,至少包括一种生物墨水和一种承重墨水;这样生物材料的机械和生物要求就可以分离。在所有这些研究中,确保高细胞存活率和良好的机械性能是关键问题。由于打印能力的限制和材料库的限制,此类支架的
3DBP 尚处于早期开发阶段,只有少数初步动物研究的研究数据可用。
来自印度马尼帕尔大学的Sanchita Bandyopadhyay-Ghosh和来自加拿大多伦多大学的Mohini
Sain团队合作从专题角度对当前的3DBP的最先进技术进行了综述,同时着重介绍了可用的 3DBP
技术、生物材料的可打印性、机械和降解行为,以及它们在骨组织康复方面的整体功效。本工作集综合并批判性地分析了针对承重支架的 3DBP
研究,以满足个性化医疗的需求。本工作重点介绍了采用热塑性塑料和磷酸盐水泥进行承重应用的 3DBP 技术的最新进展。最后,本工作展望了 3DBP
在骨科承重应用领域的未来前景。总之,这篇文章为未来的研究奠定了坚实的基础,因为它收集了科学家们可以利用的最新和正在进行的研究。相关工作以题为“Is
it possible to 3D bioprint load-bearing bone implants? A critical
review”的文章发表在2023年9月19日的国际著名期刊《Biofabrication》。

1. 内容
最近的开发出了一种
“双相支架”,其中包括与传统生物墨水一起打印的机械强度(或承重)阶段,从而在一定程度上复制了骨组织的原生环境。几乎所有此类支架中的坚硬相都由低温熔融热塑性生物聚合物或磷酸盐水泥组成,并配制成可挤出的糊状物。与传统的生物陶瓷不同,这些水泥可以在温和的条件下凝固或固化。图
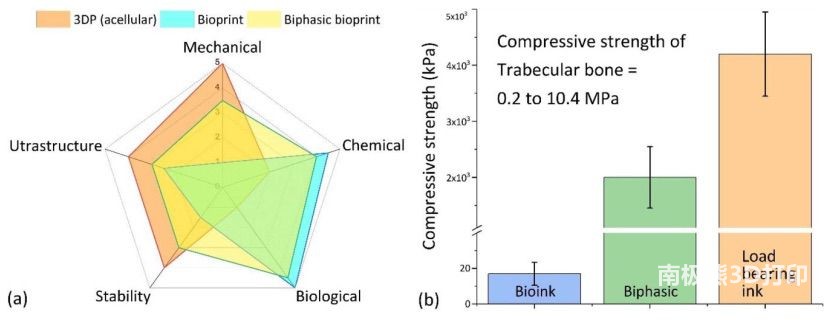
1(a) 定性比较了双相支架与生物打印和无细胞 3DP
支架的特性。双相支架代表了3D生物打印(3DBP)在化学和生物仿真之间的一种更好的平衡以及在细胞 3DP
支架上观察到的机械刚度、打印分辨率和支架稳定性。双相支架的压缩模量大约是传统 3DBP 支架的 1000 倍(图 1(b))。
【用于承载应用的 3DBP 技术】
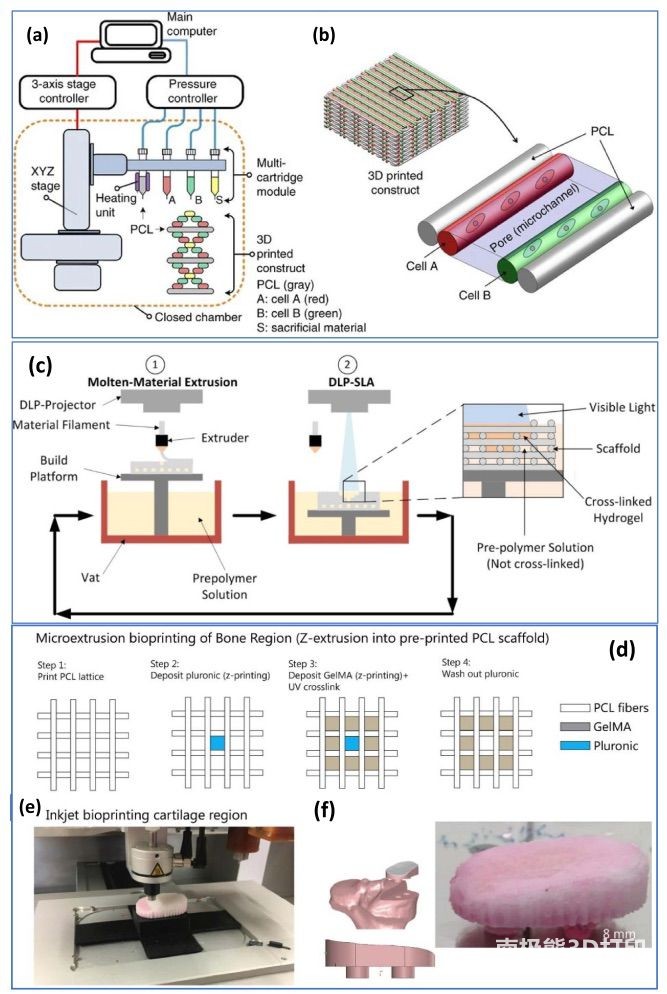
在各种技术中,基于挤压的多材料生物打印技术(图
2(a)和(b))是最简单易行的,而且可以找到相对便宜的台式生物打印机型号,因此得到广泛采用。然而,基于挤压的生物打印机打印速度慢,打印分辨率低(通常大于几百微米)。相比之下,基于
SLA 和喷墨的生物打印机理论上可以实现更高的生物墨水打印分辨率(通常小于 50 微米)。迄今为止,已有报道称喷墨或 SLA
型多材料混合生物打印机采用熔融挤出技术打印热塑性承重墨水,并通过喷墨打印头(图 2(d)-(f))或 SLA 光聚合技术(图
2(c))打印生物墨水。
【带热塑性塑料的 3DBP】
聚乳酸-共聚乙醇酸(PLGA)、聚乳酸(PLA)和聚苯乙烯(PCL)等热塑性生物材料早已被公认为具有生物医学应用前景的材料。它们的3D打印性和生物降解性进一步提高了它们的声誉。此外,这些生物材料还具有良好的机械性能,因此过去曾被用于工程承重组织构建。尽管如此,原始热塑性生物聚合物缺乏足够的生物活性,而且
3DP 所需的温度可能会诱发细胞毒性效应。尽管如此,最近的文献报道了使用热塑性聚合物作为承重相的 3DBP
承重植入物的成功尝试。从本质上讲,使用热塑性聚合物对承重植入体进行 3DBP 需要热塑性聚合物(通过熔融挤出)与至少一种生物墨水相结合的多材料
3D打印技术。
【含磷酸盐水泥的 3DBP】
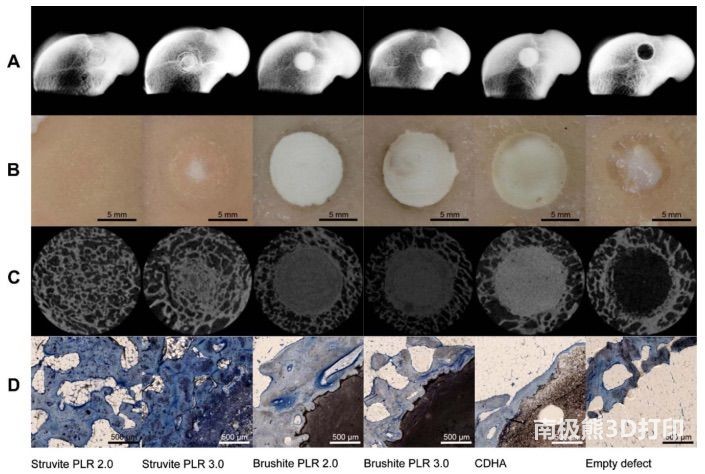
MgP 是另一类可能替代 CPC 的水泥,因为其机械强度更高,体内固化和降解速度相对更快。Kanter
等人报告了一项在成年绵羊股骨髁上对基于硬石膏、刷状石和 CDHA 的水泥进行为期 10 个月的比较研究。如图 3 所示,与两种 CaP
骨水泥相比,基于 MgP
的闪长岩骨水泥表现出更大的骨吸收率和相应更高的新骨生长率。镁磷酸盐水泥通常包括固体镁前体,使用可溶性磷酸盐(如磷酸氢二铵,DAHP和磷酸氢二钾,DKHP)固化,生成不溶性的镁磷酸盐水泥。
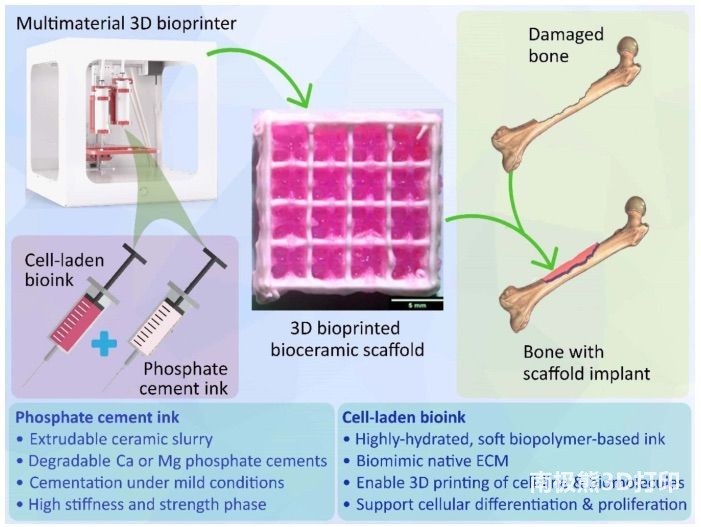
近年来的一些研究重点是在温和条件下打印高硬度磷酸盐水泥基支架,使其(a)可携带生物分子,(b)可与活组织一起打印。这种工程解决方案有可能以整体方式复制原生骨组织,并有效修复骨组织。在此阶段,本研究想说明的是,由于固化磷酸盐水泥的高硬度,使用水泥浆作为细胞系的载体可能并不可取。图
4 描述了用于 BTE 的基于磷酸盐水泥的 3D
打印支架的简化制造和植入工作流程,以及磷酸盐水泥墨水和此类技术中使用的含细胞生物墨水的主要特征。随后的章节将详细讨论正在开发的两类重要的磷酸盐水泥,以实现这种高硬度
BTE 支架的 3DBP。
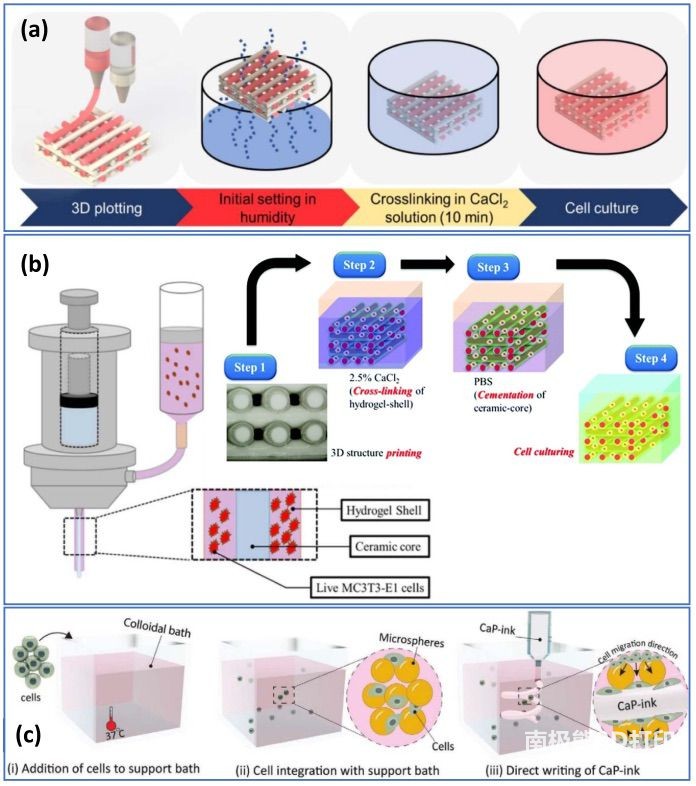
Ahlfeld 等人推进了制备硬质3D生物打印双相 BTE 支架的技术。如图 5(a)所示,他们利用多材料共挤打印油基 CPC
油墨和携带间充质干细胞(MSC)的藻酸盐生物墨水。在打印过程中,两相的存在并未对单个油墨的行为产生重大影响。支架的固化分为两个阶段:(a)在高湿度环境中固化
CPC 表面;(b)在 CaCl2 溶液中固化海藻酸盐生物墨水和 CPC 主体。这两个步骤旨在防止 CPC 阶段形成微裂缝。将 CPC
直接浸入水浴中固化会导致残余应力,并在固化反应期间形成裂缝。另一方面,最初暴露在湿气中超过 30 分钟会导致 CaP
逐渐沉淀。暴露表面的局部固化固定了打印支架的初始形状。在水浴中的进一步培养完成了固化过程,增加了水分渗透,降低了残余应力,使表面没有微裂缝,并显著提高了打印支架的抗压强度。总体而言,双相支架的压缩模量大于
30 兆帕,压缩强度为 1.3 兆帕,均大大高于传统的生物打印支架。
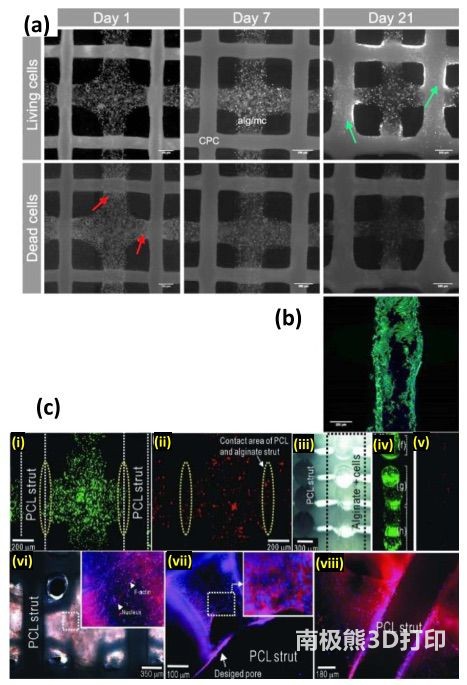
双相支架的体外细胞相容性显示,在大多数生物墨水中,CPC
墨水不会引起毒性(由于油载体释放或凝固反应)。然而,一天后在两种油墨的界面处观察到大量细胞死亡(图
6(a))。这归因于凝固反应过程中氢离子的释放。长期研究表明,细胞相容性有所改善,培养 21 天后,细胞在 CPC
相上大量生长,并随之迁移和增殖(图 6(a)和(b))。经优化的初始支架培养时间(<30
分钟)可在细胞增殖和支架强度之间取得良好的平衡。由于藻酸盐油墨本身的打印适性较差,打印样品的孔隙闭合是由于无支撑的支柱塌陷造成的,可能会阻碍细胞的运动。选择更好的生物墨水(如硬度更高的水凝胶)可能会增强3D生物打印支架的体外行为,因为这样可以打印出更大的孔,最大限度地减少
CPC
与生物墨水之间的界面,并相应地提高支架培养初期的细胞存活率。此外,这项工作还通过开发患者特异性生物墨水得到了扩展,将直接取自患者的血浆融入其中。通过这种方法向缺损部位输送免疫调节蛋白,有望引起有利的免疫反应,增强受损组织的愈合能力。
【对 3DBP 承重生物材料的严格评价】
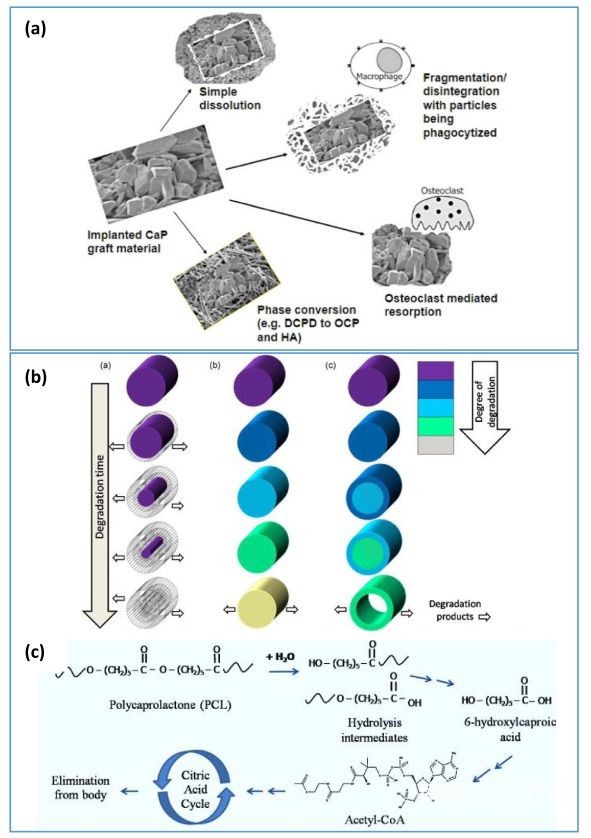
由于 CaP 基 3DP 油墨与原生骨的矿物相类似,因此在开发承重 3DBP 支架方面,对 CaP 基 3DP 油墨的研究相对多于镁基 3DP
油墨。CaP 墨水的生物降解发生在(a)溶液驱动的溶解和(b)破骨细胞介导的吸收(图 7(a))。在固化 CPC
中发现的两个主要相中,磷灰石相是生理 pH
值下热力学上最稳定的相。因此,它们主要通过破骨细胞活动被吸收。尽管这种吸收相对要慢得多,但破骨活动会形成独特的
“豪西普裂隙”。由于其有利的界面,这些吸收部位可以成为新骨形成的热点。此外,CPC 中的离子置换已被证明可控制破骨细胞的活性,即Sr2+
离子可通过抑制基质金属蛋白酶(MMP 1 和
2)的分泌来抑制破骨细胞的活性。因此,吸收的减少有助于提高整体骨修复率。另外,碳酸根离子取代的磷灰石显示出更快的降解潜力,从而加速了吸收过程。顺便提一下,Innotere
小组报告的 3D 打印 CaP 墨水中含有一定量的碳酸钙,从而缓解了 CDHA 降解速度慢的问题。图 8 总结了文献中报道的用于开发骨科用承重
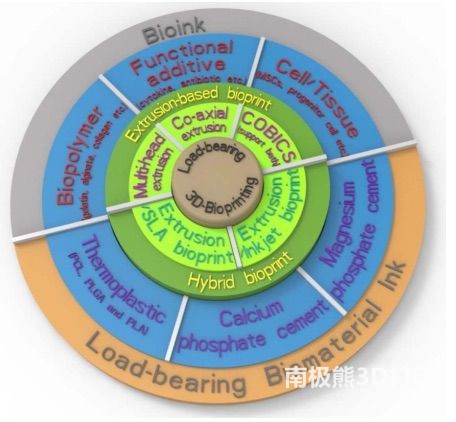
3DBP 支架的各类材料(承重生物材料墨水和生物墨水)和生物打印技术。
当然,为了开发有效的 BTE
支架,需要研究骨生物矿化的相关机制。在原生骨中,矿化过程以软骨内骨化为主。虽然胶原基质是矿物质沉积的模板,但人们普遍认为非胶原蛋白(NCP),包括糖蛋白和蛋白聚糖在调节生物矿化过程中起着至关重要的作用。除了在胶原纤维的间隙区域引导矿物相的自组装之外。NCP
带有大量负电荷,可与无定形磷酸钙(ACP)形成蛋白质-矿物质复合物。这些带负电荷的复合物具有以下优点:(i) 可防止 HA
在间隙部位沉淀,(ii) 为 ACP 在纤维内向胶原缝隙区带正电荷的 N 端渗透提供静电势。图 9
展示表示了这一机制,并附有未矿化和完全矿化胶原纤维的 TEM 图像。

【展望未来】
相比之下,使用 CaP 粘合剂进行 3D 打印则面临不同的挑战,例如,由于水介质的打印窗口较短,因此不能可靠地用作载体介质。因此,有一些涉及油基
CPC
油墨的研究报告称,这种油墨与含有细胞的生物墨水一起打印时具有极佳的可打印性。虽然这些研究显示了良好的细胞相容性和体外培养过程中出色的细胞增殖能力,但迄今为止还没有研究能够证明这种双相支架的再生能力。Ahlfeld
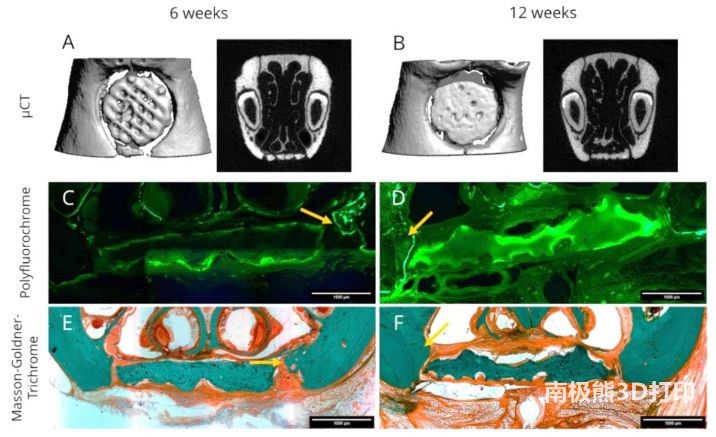
等人在最近的一项研究中尝试在 Lewis 大鼠的颅面缺损中测试双相 CPC 支架的体内修复能力,结果令人欣喜(图
10)。然而,由于打印技术的分辨率限制,作者未能使用多通道打印技术打印出足够小的部件。解决这一问题的可能替代方法是使用多轴核/壳打印技术,Raja
和 Yun
在其他地方也报告了这一方法。尽管如此,多材料挤压3D打印的低打印分辨率问题依然存在,并对复杂解剖形状部件的3D生物成型技术提出了巨大挑战。
2. 总结
3DBP 因其卓越的再生能力而在生物医学工程领域得到广泛认可。然而,3DBP
支架的机械性能和稳定性较差是其显著的缺点,也是其转化研究的主要挑战。在现有的制造技术中,承重 3DBP
支架已成为一种可行的解决方案,它可以仿生本地组织的异质性,同时改善骨科应用中组织工程构建物的机械性能。用于承重应用的 3DBP 可以理解为
“多材料” 3D 打印,其中至少有一种打印墨水是承重相,与其他生物墨水一起进行 3D
打印,从而使承重相的打印和凝固/固化过程在温和的条件下进行,而不会对打印的活组织和生物分子的活力产生不利影响。严格的材料和加工要求严重限制了可使用的承重生物材料油墨类型。迄今为止,只有热塑性塑料和磷酸盐水泥基油墨被报道为可行的候选材料,其中磷酸盐水泥基油墨因其成骨性、高硬度和优异的降解性能而成为近年来的首选。尽管如此,该领域仍处于早期发展阶段,在尝试临床试验之前,需要解决打印分辨率低、材料库有限、机械强度不达标等挑战。具备高度多学科技能的实验室和监管协议的建立对于将此类3D生物打印承重支架转化为临床实践至关重要。本综述旨在整合不同领域的相关信息,从而为支持该领域的未来研究奠定基础。总之,本综述相信承重式
3DBP
有足够的潜力来应对个性化医疗中尚未解决的挑战,从而实现高效的骨康复。随着时间的推移,预计该技术将足够成熟,能够在临床环境中修复骨组织缺损以及进行全骨置换。
文章来源:
https://iopscience.iop.org/article/10.1088/1758-5090/acf6e1



0 留言