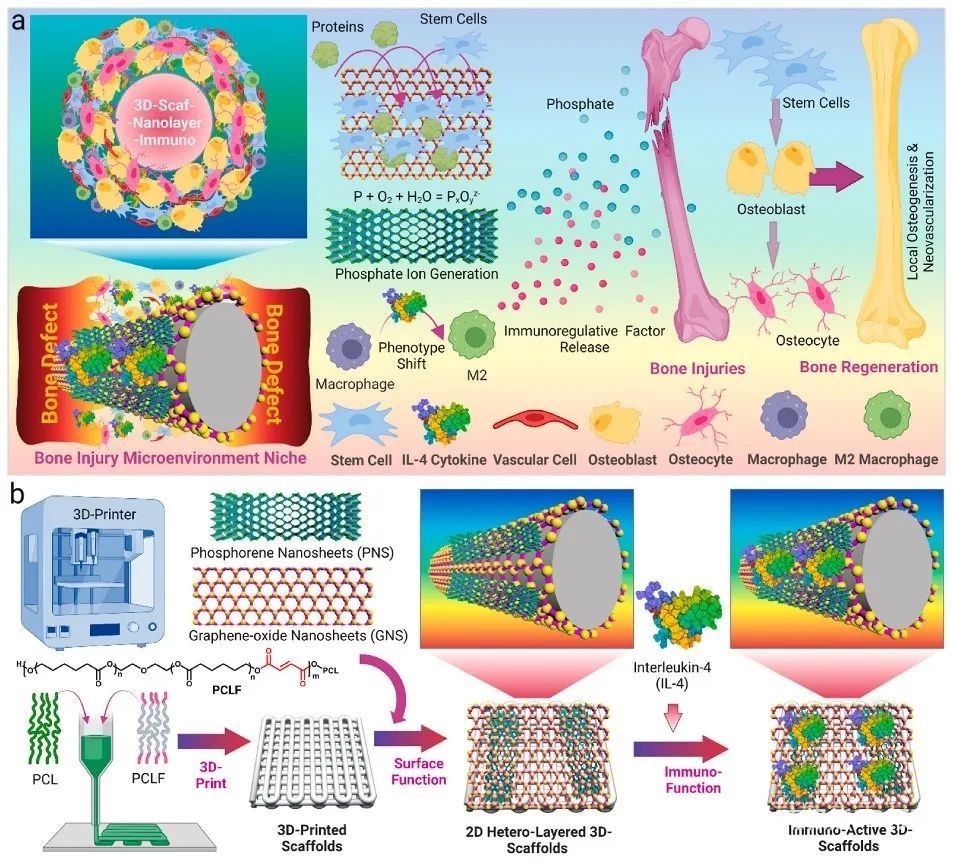
三维(3D)打印技术正在推动包括组织工程在内的各个工程领域的进步。然而,原始的3D打印支架通常缺乏强大的功能来刺激各种再生应用所需的活动。近日,来自美国罗切斯特大学的Lichun
Lu团队将二维(2D)异质纳米结构和免疫调节白细胞介素4(IL-4)细胞因子相结合,用于3D打印支架的功能化,以实现促进愈合的免疫微环境,以优化骨损伤维修(图1)。在大鼠体内植入后,具有免疫功能的
3D 支架通过构建促愈合免疫微环境实现体内骨免疫调节,从而促进缺损区域的血管生成和成骨,从而促进骨再生。这些结果表明,具有二次加载免疫调节细胞因子的2D异质纳米结构的3D支架的免疫功能化是改善骨再生的令人鼓舞的策略。相关论文“3D-printed
scaffolds with 2D hetero-nanostructures and immunomodulatory cytokines
provide pro-healing microenvironment for enhanced bone
regeneration”于2023年4月13日在线发表于杂志《Bioactive Materials》上。
1. 异质纳米结构的表征
首先,研究者合成了由氧化石墨烯(GO)层和黑磷(BP)纳米片组成的2D异质纳米结构。TEM和SEM证实了超声处理后尺寸范围为纳米级的小BP纳米片的产生(图2a),AFM表明剥落的BP纳米片具有多层结构(图2b)。TEM图像证实了氧化和剥落后GO纳米片的产生(图2c),AFM测试检测到高度约为1-2
nm(图2d)。将GO纳米片和BP纳米片混合后,得到含有两层二维材料的异质纳米结构。TEM图像表明BP纳米片与GO纳米片均匀分布(图2e),GOBP异质纳米结构的详细可视化表明,BP纳米片被大面积GO层完全包裹。这些表征表明,BP纳米片和GO纳米片这两种类型的二维材料并不相互排斥,因此可以成功地应用于形成异质纳米结构(图2f)。
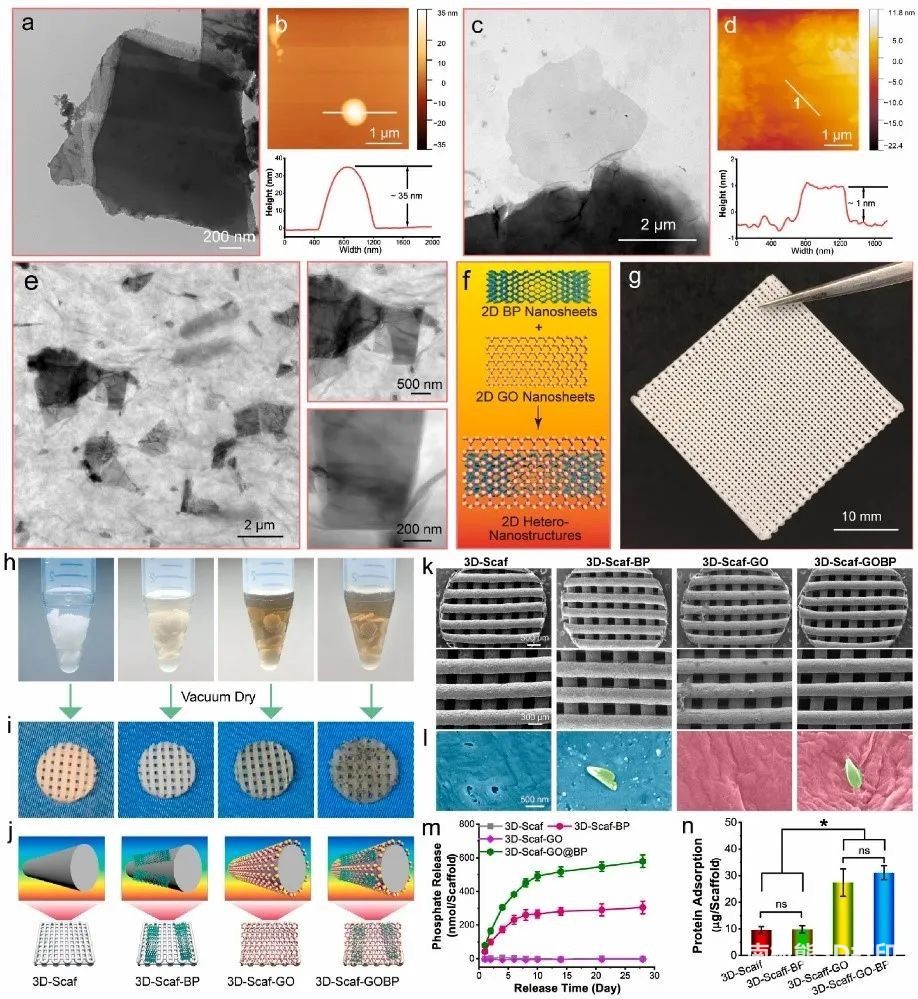
2. 3D聚合物支架的印刷与功能化
然后,作者在Bio-X打印机上打印了聚合物1D支架(图2g),将得到的3D支架浸入具有各种2D材料的溶液中,即GO纳米片,BP纳米片和GOBP异质纳米结构进行表面功能化(图2h)。具有3D
GOBP异质纳米结构的2D支架在深色的表面上显示出基本的2D材料(图2i)。3D支架的SEM显微镜在纳米尺度上显示了聚合物支架表面2D材料的相应特征(图2k-l)。在涂覆一层2D
BP纳米片后,得到的3D-Scaf-BP支架具有随机分散在表面上的BP纳米片涂层,如图2l中的绿色所示。此外,BP纳米片可以通过与氧气和水反应缓慢氧化,以连续释放磷酸根离子(图2m)。
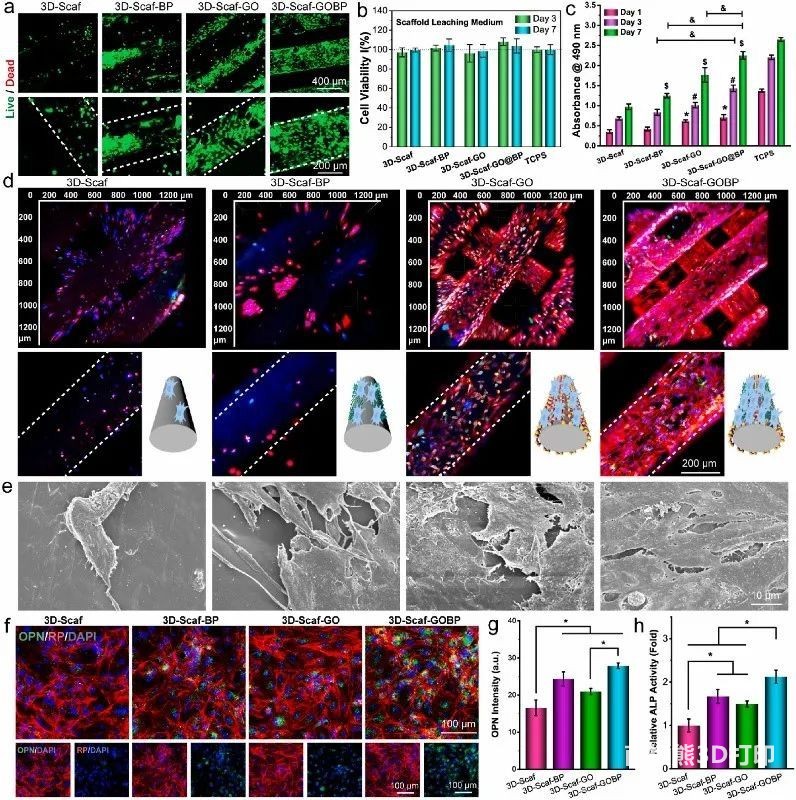
3. 干细胞增殖和成骨
2D材料功能化3D支架的生物相容性对于体内植入至关重要。活/死染色和浸出培养基对共培养干细胞的活力实验表明,功能化的3D支架对干细胞没有细胞毒性,也不会向培养基释放有毒物质,因此具有生物相容性,适用于体外细胞研究和体内植入。增殖实验表明,干细胞在所有4种类型的3D支架上都显示出生长趋势,类似于TCPS对照(图3c),重建的3D扫描共聚焦图像显示大量干细胞粘附在3D支架的顶部和内部脊上(图3d),干细胞的SEM图像与未功能化的纯2D支架相比,3D纳米片上的丰度细胞和异质纳米结构功能化的3D支架显示出一致的趋势(图3e)。与干细胞共培养14天后,通过免疫荧光染色可视化成骨制造蛋白OPN的表达。结果表明,2D
GO纳米片和功能化支架释放的磷酸根离子可以促进细胞成骨(图3f-h)。
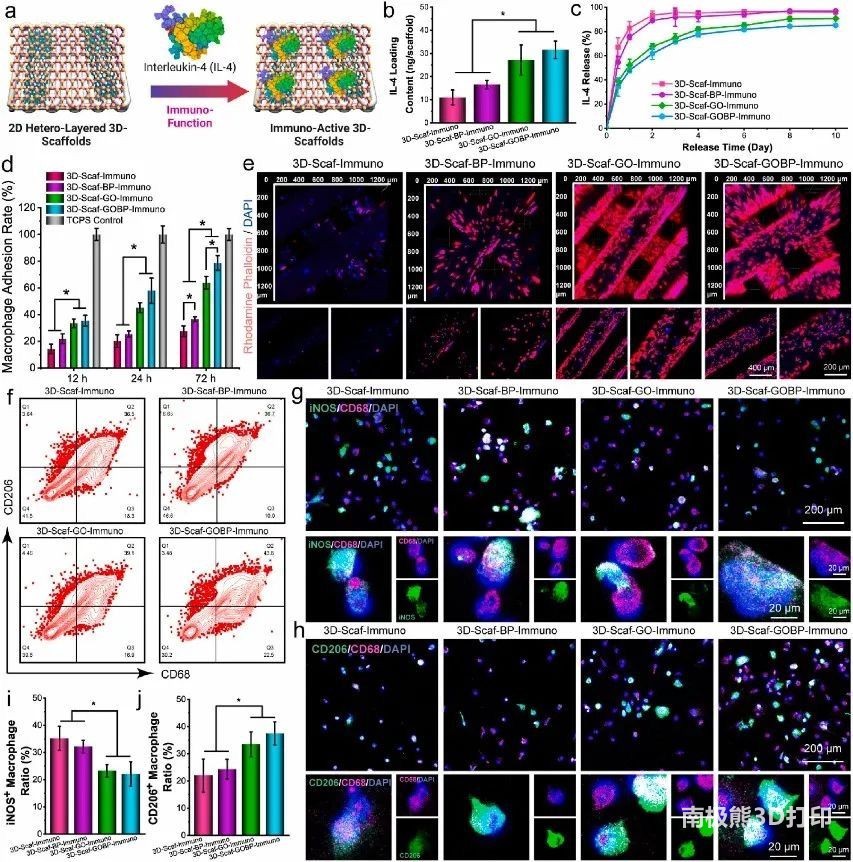
4. 3D 支架的免疫功能和巨噬细胞反应
将未功能化的纯3D支架和2D材料功能化的3D支架全部浸入大鼠IL-4溶液中以吸收IL-4细胞因子(图4a)。结果表明,用GO或GOBP异质结结构的3D支架上的IL-3负载量含量更高(图4b-c)。在接种3、12和24小时后测试骨髓来源巨噬细胞(rBMDM)对灭菌的免疫功能72D支架的粘附,结果表明:3D-Scaf-GOBP-免疫支架具有最多的巨噬细胞数量,显示出巨噬细胞吸引和增殖的最佳特性(图4d),免疫荧光图像显示出一致的结果(图4e)。巨噬细胞表型变化结果显示,通过异质纳米层改进的IL-3细胞因子负载和释放可以在粘附在3D支架上实现巨噬细胞的有效表型极化(图4f-j)。
5. 巨噬细胞对血管形成和成骨的影响
为了探索巨噬细胞响应免疫功能3D支架是否会影响邻近细胞的血管形成和成骨,将巨噬细胞的释放培养基与HUVEC和rBMSC共培养(图5a)。如图5b-f所示,不同基因的相对mRNA表达量不同。在与免疫功能化3D支架的IL-3细胞因子诱导的巨噬细胞上层共培养的HUVECs中检测到血管基因表达较高的总体趋势。对于成骨分析,显示与血管标志物相似的趋势,其中检测到由3D-Scaf-GOBP-免疫支架浸出培养基诱导的巨噬细胞上消化母共培养的rBMSC的最高值(图5i-m)。
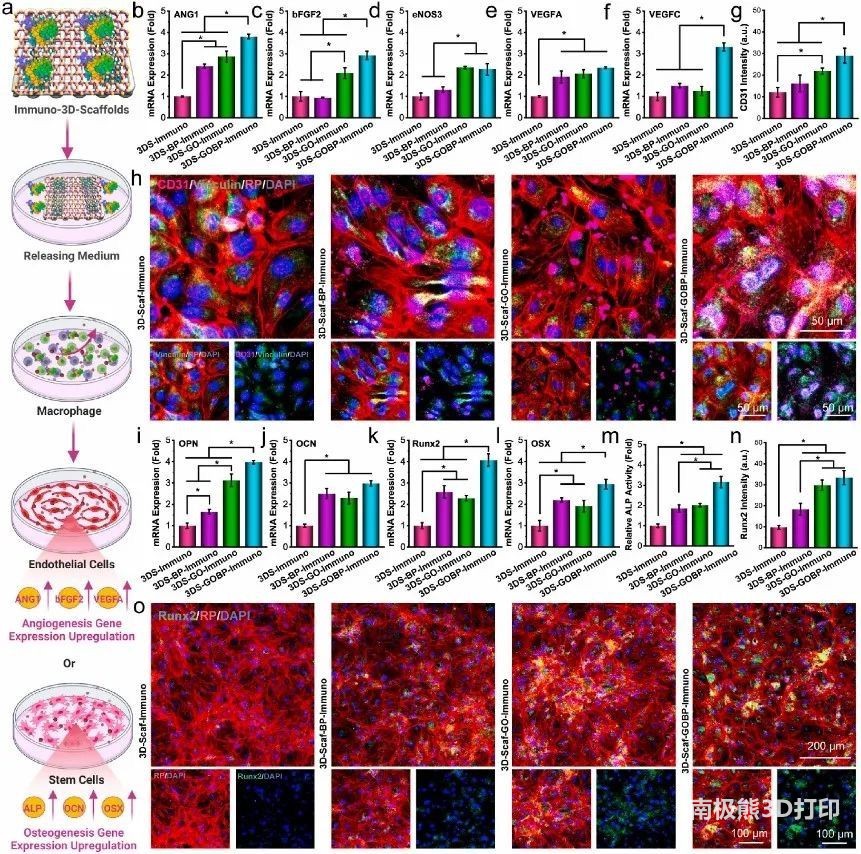
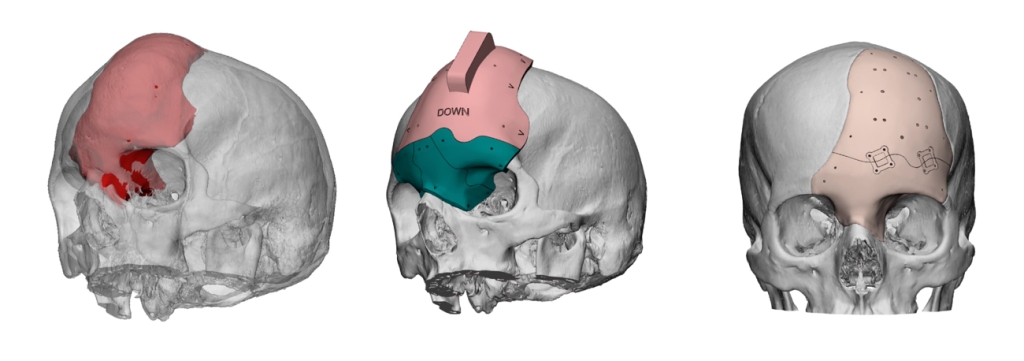
6. 3D免疫支架的体内骨再生
在骨缺损部位,损伤微环境生态位涉及各种细胞和因素(图6a)。创建直径为5
mm的全层骨缺损,并将3D支架植入缺损中(图6b)。4周后,收获颅骨碎片以分析骨形成(图6c-d)。如图6e所示,显微CT图像表明,植入3D支架的缺损部位内的新骨形成更显着,空对照的新骨形成最少。对于用3D材料功能化的三种类型的2D支架,沿着缺陷边缘形成了小规模的完整骨块(图6e)。此外,免疫调节细胞因子负荷可进一步加速骨形成(图6f-h)。主要器官的HE染色表明,本研究中使用的3D支架在体内条件下具有生物相容性,与体外细胞评估一致(图6i)。
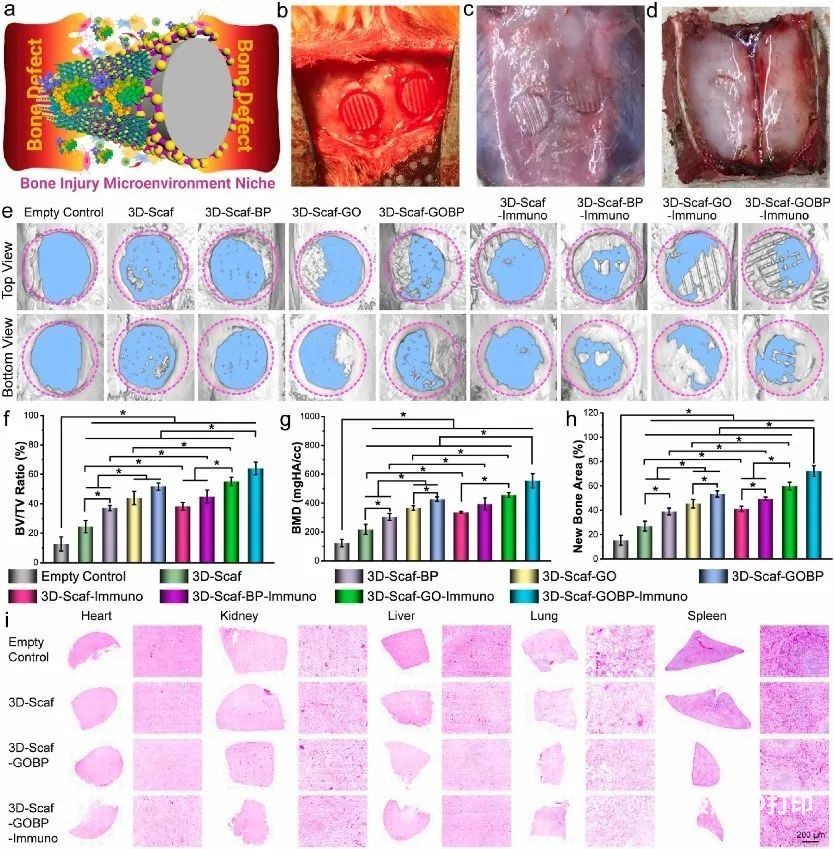
7. 体内新生血管形成和成骨
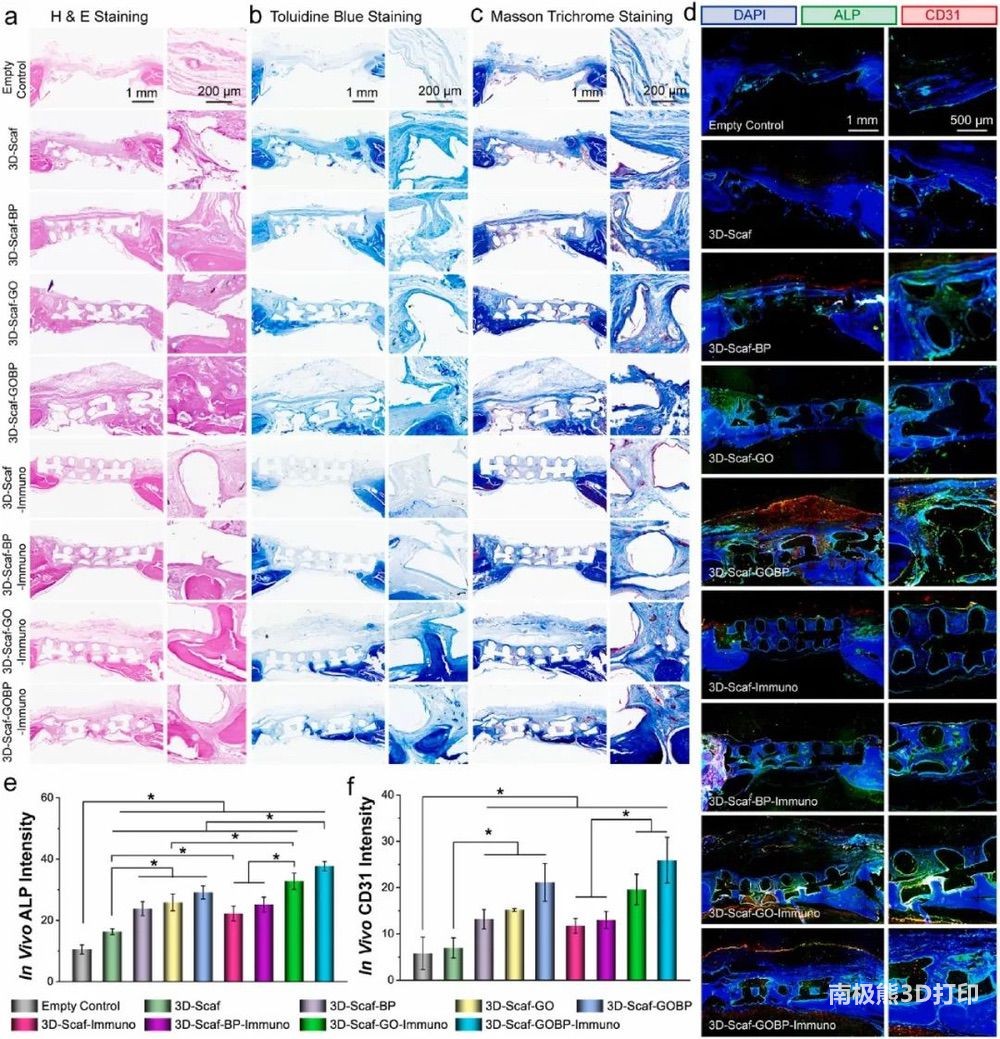
为了评估在颅骨缺损部位植入的3D支架的骨修复,收获的骨组织在嵌入石蜡后进行脱钙和切片。图7a-c显示,3D支架可以桥接骨缺损,并为细胞在骨缺损区域进行和分配提供优异的组织导电性。CD31和ALP表明支架植入促进了细胞募集和组织形成(图7d),荧光强度的定量结果也与之相符(图7e-f)。
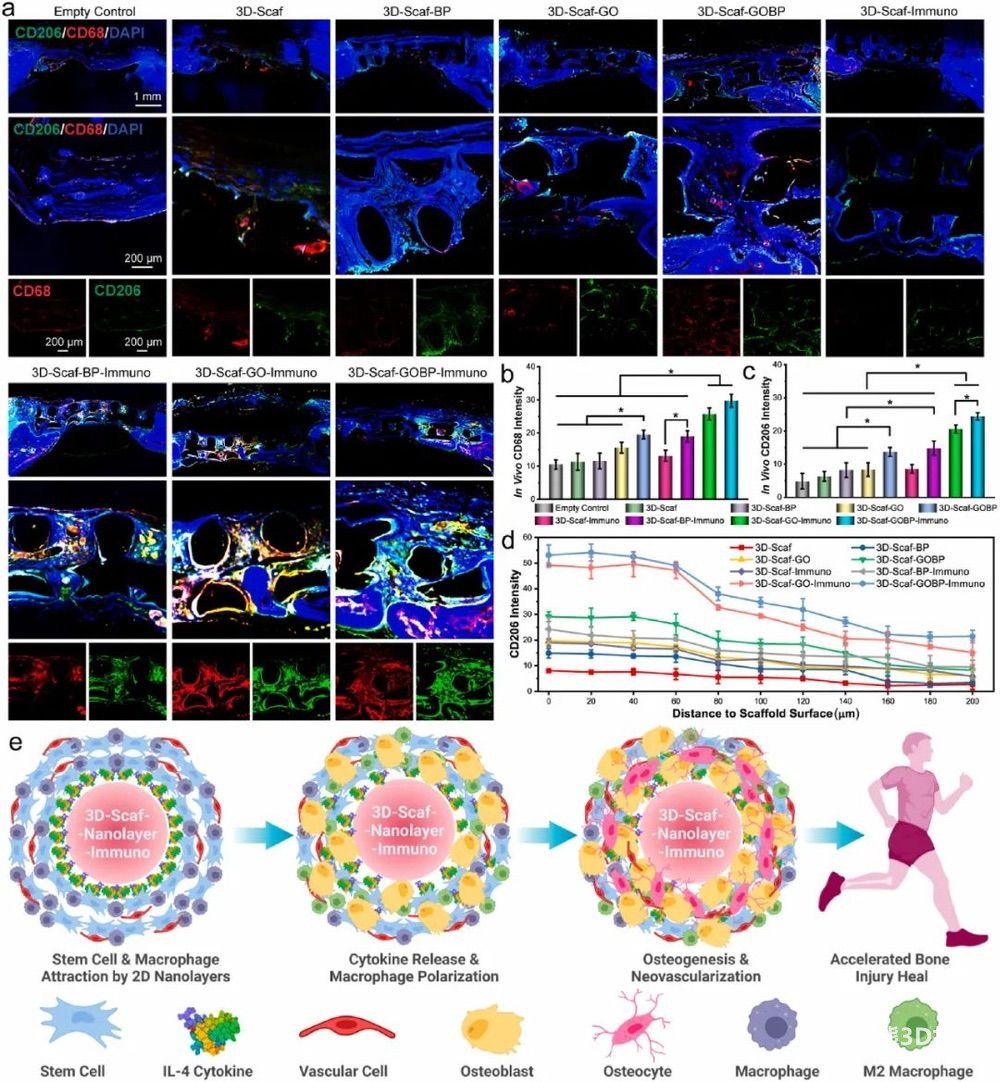
8. 体内M2巨噬细胞表型调节
为测定骨缺损体内巨噬细胞募集和M2表型极化,对颅骨进行CD68和CD206免疫荧光双染色。对于3D-Scaf-GOBP,在组织内观察到CD68和CD206荧光的广泛分布,表明异质纳米结构的功能可以增强巨噬细胞对3D支架的募集(图8a),定量计算与荧光图像一致(图8b-c)。CD206荧光的体内分布表明了偏振M2巨噬细胞的位置,对于这些3D支架来说是独一无二的(图8a)。观察到有效的CD206荧光包围植入的3D支架脊,表征了CD206荧光强度与到支架脊表面的距离的关系(图8d)。
综上,本文通过结合3D异质纳米结构和免疫调节IL-2细胞因子,成功构建了免疫功能化的3D支架,并通过创建促愈合的免疫微环境优化了体内骨损伤修复。体外测试表明,由GO和BP纳米片组成的二维异质纳米结构可以提高细胞粘附,磷酸根离子的持续释放刺激细胞增殖和成骨。二维异质纳米层还增加了免疫调节IL-2细胞因子的负载量,并调节巨噬细胞极化为M2表型,以构建有利于愈合的免疫微环境,以改善血管生成和成骨。体内植入结果表明,免疫功能化的3D支架桥接损伤缺陷,增强细胞募集,并通过磷酸盐的持续释放刺激体内新生血管和成骨作用。负载的IL-2细胞因子进一步促进了巨噬细胞极化为M3表型,这可能有助于建立促进愈合的微环境以加速骨损伤恢复。因此,具有免疫调节细胞因子二次加载的2D
GOBP异质纳米结构的3D支架的免疫功能化可以为3D打印的支架提供支持快速骨损伤恢复的有希望的策略。
文章来源:https://doi.org/10.1016/j.bioactmat.2023.03.021


0 留言