糖尿病(DM)是一种慢性代谢性疾病,影响着全球近 4.63 亿成年人。随着人口年龄的增长,糖尿病的发病率也在不断上升。大约四分之一的糖尿病患者会出现糖尿病足溃疡(DFU),五年死亡率为 30.5%,与癌症(31%)的死亡率相接近。糖尿病足溃疡与慢性疼痛、自我护理能力下降、长期感染、足部截肢的高风险以及全球约 85 亿美元的沉重经济负担有关。脱位疗法、负压疗法、手术清创和抗生素等保守疗法往往无法取得令人满意的疗效,而且还会产生不良反应。高糖诱导的血管内皮损伤是糖尿病伤口不愈合的一个主要病理因素。
为了阻断这一病理过程,来自南京工业大学的迟波和南京大学的吴秀文、任建安团队合作设计了一种全肽可打印水凝胶平台,该平台基于硫醇化γ-聚谷氨酸、甲基丙烯酸缩水甘油酯共轭γ-聚谷氨酸和硫醇化精氨酸-甘氨酸-天冬氨酸序列的高效、精确的一步点击化学反应。血管内皮生长因子 165 过度表达的人脐静脉内皮细胞就是利用这一平台打印出来的,从而制造出具有高细胞活力和精确细胞空间分布控制的活体材料。这种含有细胞的水凝胶平台可加速大鼠糖尿病伤口的愈合,因为血管内皮生长因子 165 可持续释放,促进血管生成,减轻对血管内皮线粒体的损伤,从而减少组织缺氧,降低炎症反应,促进细胞外基质重塑。总之,这项研究为制造组织友好、高效、精确的三维打印全肽水凝胶平台提供了一种用于细胞递送和自我更新生长因子疗法的可行策略。相关工作以题为“A click chemistry-mediated all-peptide cell printing hydrogel platform for diabetic wound healing”的文章发表在2023年11月29日的国际顶级期刊《Nature Communications》。

1. 创新型研究内容
本研究利用硫醇化γ-聚谷氨酸(γ-PGA-SH)、甲基丙烯酸缩水甘油酯共轭γ-聚谷氨酸(γ-PGA-GMA)和硫醇化精氨酸-甘氨酸-天门冬氨酸(RGDC)序列设计了一种细胞可打印水凝胶平台,其中 RGDC 是一种支持细胞粘附和扩散的整合素受体(图 1A,B)。该平台是通过一步凝胶化法构建的,具有硫醇-烯点击反应高效、精确等固有特点(图 1C)。由此产生的肽基水凝胶平台有望成为高效的细胞和生长因子输送载体,并创造出一种近似皮肤组织理化特性的活体材料。此外,本研究用携带 VEGF 165 转录本的慢病毒将人脐静脉内皮细胞(HUVECs)基因修饰为HUVECsvegf165+,以进行过表达(图 1D)。与加载生长因子的传统策略不同,通过 DLP 打印将细胞加载到水凝胶平台后,作为细胞载体的 HUVECsvegf165+ 负责 VEGF 165 的连续生成。虽然之前的研究表明血管内皮生长因子对糖尿病伤口愈合有效,但其潜在机制并不完全清楚,主要归因于组织血管生成。本研究清楚地阐明了 VEGF 165 的信号转导机制,它能阻碍 Bax 诱导的线粒体膜(MMs)孔形成,从而改善内皮细胞凋亡并保留血管生成的潜力。然后,利用糖尿病大鼠模型,全面评估了这种含有细胞的水凝胶平台在糖尿病伤口愈合中的疗效(图 1E),包括伤口闭合率、血管生成、上皮化、疤痕风险、毛发形成、基质细胞代谢、组织缺氧和炎症。
【设计并优化了一步光固化全肽水凝胶】
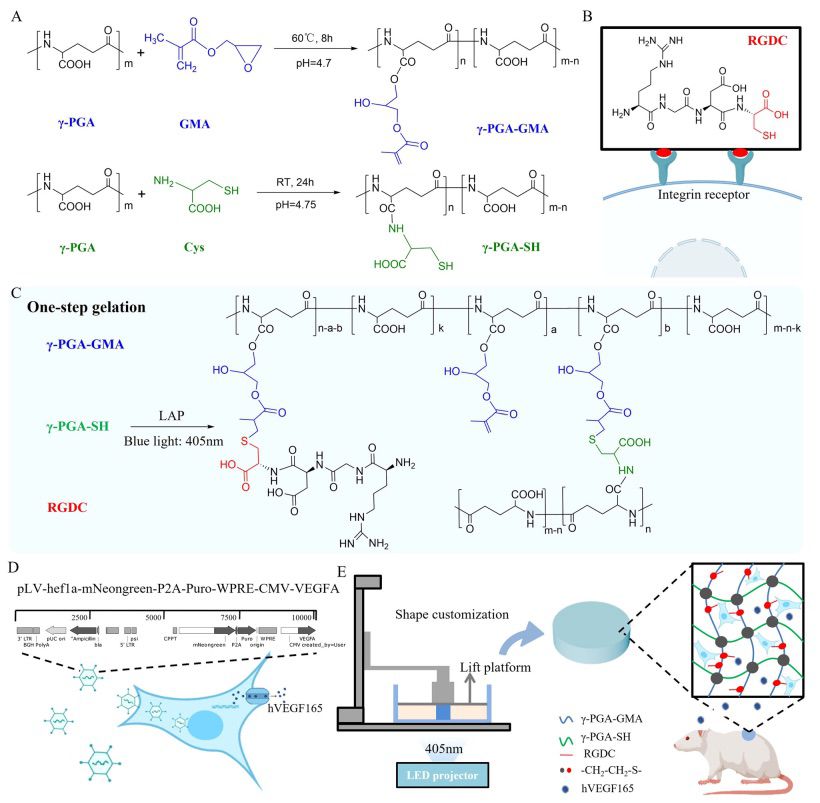
γ-PGA-GMA是通过γ-PGA和GMA的环氧开环反应合成的。1H 核磁共振(NMR)和傅立叶变换红外(FTIR)光谱证实了γ-PGA-GMA 的合成。如图 2A 所示,γ-PGA-GMA 的光谱在 6.27 ppm(a)和 5.64 ppm(b)处出现了两个新峰,这两个峰都对应于 GMA 的乙烯基(C = C)的质子。将 5.64-6.27 ppm 的乙烯基信号积分面积与 4.13-4.52 ppm 的甲基质子信号积分面积(c)进行比较,计算出 GMA 的取代度为 28%。在傅立叶变换红外光谱(图 2B)中,γ-PGA-GMA 出现了 1637 cm-1 的吸收峰,该吸收峰归因于 GMA 的乙烯基,从而进一步验证了共轭的成功。将γ-PGA-GMA、γ-PGA-SH、RGDC 和光引发剂 LAP 简单混合,就能生产出基于硫醇-烯点击反应的水凝胶。点击反应是指通过杂原子连接(C-X-C),开发一套快速、高可靠性、高产率和高选择性的反应,用于快速合成有用的新化合物和组合库。为了研究凝胶化的可行性并优化水凝胶的物理性质,本研究利用了不同组成(4.5、5.0、5.5 和 6.0 w/v%)的 γ-PGA-GMA 和 γ-PGA-SH,并随着聚合物浓度的增加分别命名为凝胶 1、凝胶 2、凝胶 3 和凝胶 4。由于凝胶 2 的储存模量(G′)的变化与光的开和关的控制密切相关,因此在蓝光(n = 405 nm)照射下水凝胶可以快速交联(图 2C)。与本研究团队之前报道的基于γ-PGA 的水凝胶相比,在预凝胶混合物中加入 LAP 大大缩短了凝胶化时间,从 7 分钟以上缩短到 20 秒以内,大大节省了材料,因此这种凝胶配方更适合作为光固化印刷的生物墨水。
【基于全肽水凝胶的高效精准 DLP 打印平台的开发】
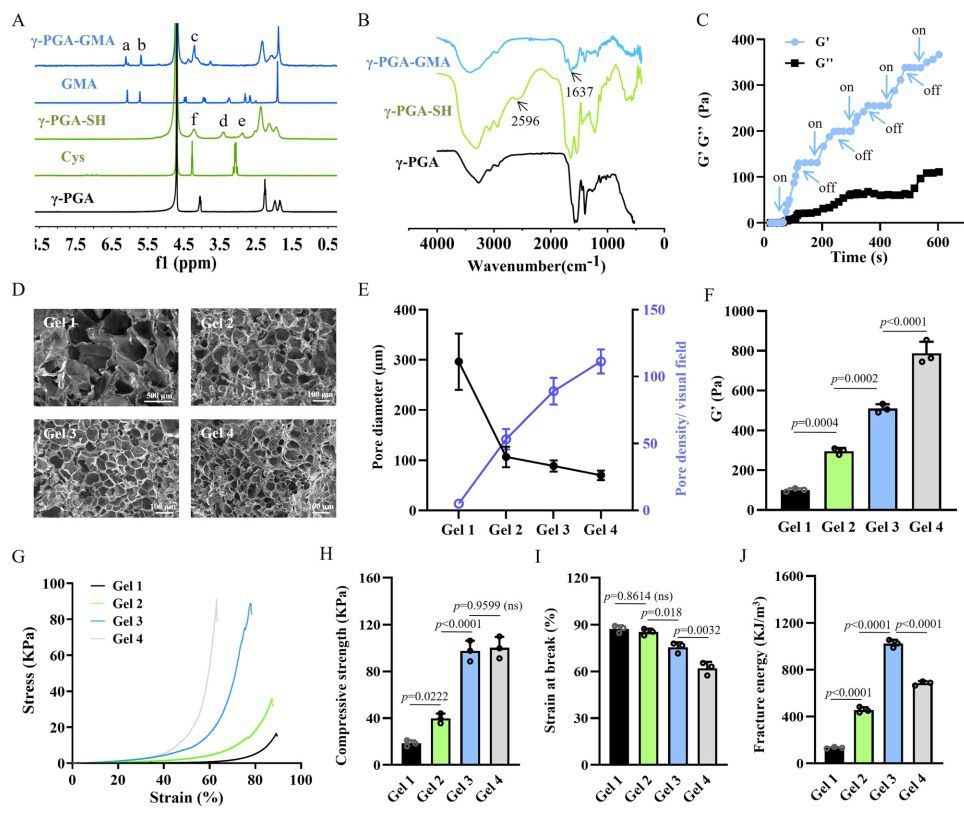
如图 3A 所示,本研究设计并测试了一个用作打印原型的扁平圆柱体,每层分别暴露在蓝光下 16、24、32 或 40 秒。每层光照射时间的延长导致总打印时间增加,效率降低(图 3B)。不过,适当延长光照射时间可使相邻平面的切角接近 90°,从而提高圆柱体的打印精度(图 3C)。随着 G′的增加,光照时间的延长也提高了所制备水凝胶的机械强度(图 3D)。考虑到打印速度、精度和机械性能之间的平衡,本研究选择了 32 秒的光照时间。然后,本研究将打印层厚度从 0.1 毫米调整到 0.4 毫米(图 3E)。层厚的增加大大缩短了打印时间(图 3F)。此外,由于层厚增加时相邻平面的切角偏离 90°较远,打印精度略有下降(图 3G)。当层厚度增加时,印刷水凝胶的机械强度下降(图 3H)。考虑到打印效率、精度和机械性能,本研究选择 0.2 毫米的层厚进行以下实验。
为了进一步确定 DLP 印刷水凝胶的分辨率,本研究设计了一个梳子模型,相邻梳齿的梯度距离从 3 毫米到 0.25 毫米不等(图 3I)。梳子模型被精细地打印在平台上,表面粘有少量未交联的生物墨水。将梳子浸入水中去除多余的生物墨水后,梳齿的间距就能更好地观察到,直到间距缩短到 0.5 毫米时,梳齿才能被抬起。当间隔距离设定为 0.25 毫米时,梳齿之间的间隙消失了。这些结果意味着印刷分辨率可以达到 0.5 毫米(图 3J)。为了确定打印误差范围,本研究设计了一个微管壁厚为 0.5 毫米的微管阵列。打印完成后,使用异硫氰酸荧光素(FITC)对微管壁进行染色,在共聚焦显微镜下测得微管壁厚度为 0.622 毫米。因此,计算出的打印误差为 0.122 毫米(图 3K)。这一结果可以解释梳齿间隙在 0.25 mm 间隔内消失的原因,因为相邻梳齿的打印误差范围累计接近 0.25 mm。根据 DLP 打印γ-PGA 水凝胶的分辨率和保真度,打印出了不同形状的物体,如六角形花瓣、微孔支架和耳朵模型(图 3L)。
【使用全肽生物墨水共同印制 HUVECsvegf165+,细胞存活率和增殖情况令人满意】
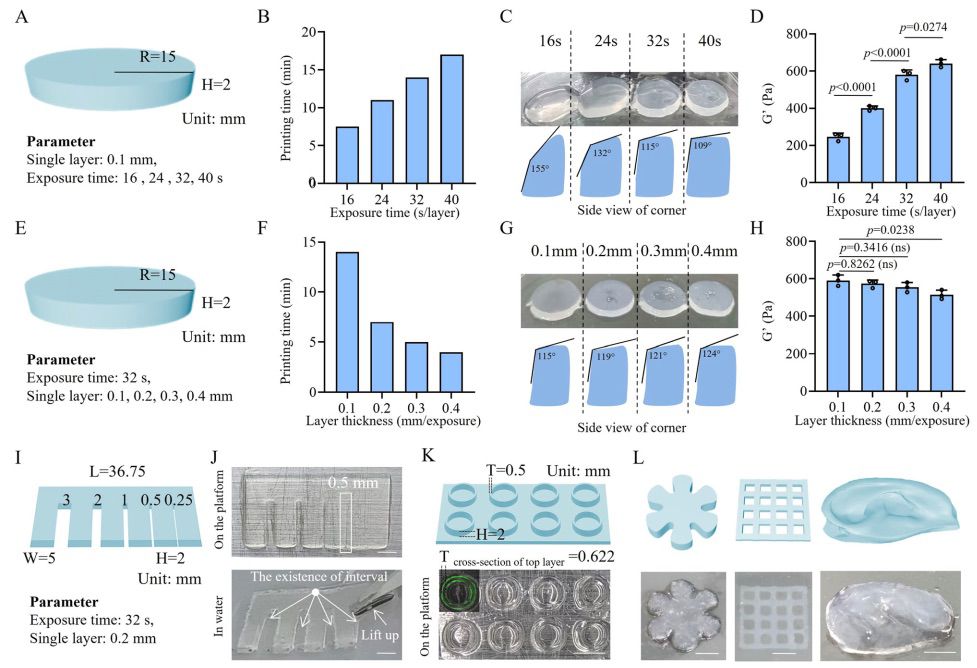
本研究构建了感染 HUVEC 的特异性慢病毒质粒(pHS-AVC-1580),其中含有编码 NheI 和 PvuII 限制性内切酶、mNeongreen 绿色荧光蛋白(GFP)、中和嘌呤霉素的嘌呤霉素 N-乙酰转移酶和 VEGF 165 的转录本(图 4A)。无 VEGF 165 转录本的慢病毒质粒(pHS-AVC-ZQ328)用作对照。经 NheI 和 PvuII 消化后,通过基因测序和 DNA 电泳验证了过表达 VEGF 165 的慢病毒质粒的基因序列和结构。图 4B 证实了 VEGF 165 转录本信号的存在,图 4C 显示质粒片段在消化后符合预期大小。在感染对照组和 VEGF 165 高表达慢病毒并用嘌呤霉素选择后,本研究成功生成了 HUVECsvector 和 HUVECsvegf165+,其中 GFP+ 细胞的比例高达 90%以上。与 HUVECsvegf165+ 中的 VEGF 信号相比,HUVECsvegf165+ 中的 VEGF 信号明显增加。将 HUVECsvegf165+(1×105 个细胞/毫升)与全肽生物墨水共同印制成扁平的圆柱形细胞片。细胞片培养后,在 IVIS 光谱成像下,GFP 强度逐渐提高(图 4D、E),这意味着细胞转录活性得以维持,细胞数量可能增加。为了进一步确定细胞的增殖情况,使用共聚焦显微镜对细胞片进行了 Z 轴堆叠,结果显示细胞数量有所增加(图 4F)。此外,细胞计数试剂盒-8(CCK-8)检测也证实了细胞片中 HUVECsvegf165+ 的明显增殖(图 4G)。
【HUVECsvegf165+负载的水凝胶以自我更新的方式释放血管内皮生长因子165,促进体外血管生成,并通过抑制Bax诱导的线粒体穿孔保护内皮细胞免受HG诱导的损伤】
通过载入活细胞,本研究认为 HUVECsvegf165+ 水凝胶是一种活材料,具有显著的 VEGF 165 自我更新能力,而 VEGF 165 是 VEGFA 的剪接变体,可以分泌到细胞外。为了验证这一点,本研究比较了负载 HUVECsvegf165+ 的水凝胶、负载 HUVECvector 的水凝胶和负载 VEGF 165 重组蛋白的水凝胶的 VEGF 165 释放动力学。HUVECsvegf165+ 水凝胶释放的 VEGF 165 量远高于 HUVECvector 水凝胶。刷新培养基后,负载 VEGF 165 的水凝胶的 VEGF 165 释放量明显减少,但负载细胞的水凝胶的 VEGF 165 释放曲线与刷新培养基前基本一致。总之,这些实验表明,HUVECsvegf165+负载的水凝胶能以自我更新的方式释放血管内皮生长因子 165,从而增强旁分泌作用。为了进一步研究 HUVECsvegf165+ 水凝胶释放的可自我更新的 VEGF 165 的生物学功能,本研究利用 transwell 小室系统建立了一个共培养细胞模型,将细胞负载的水凝胶置于上腔,HUVECs 被接种于下腔(图 5B)。与添加 HUVECsvegf165+ 的水凝胶相比,添加 HUVECsvegf165+ 的水凝胶能促进伤口愈合(图 5C、D)、细胞增殖(图 5E)和 HUVEC 在底腔形成管(图 5F-H)。
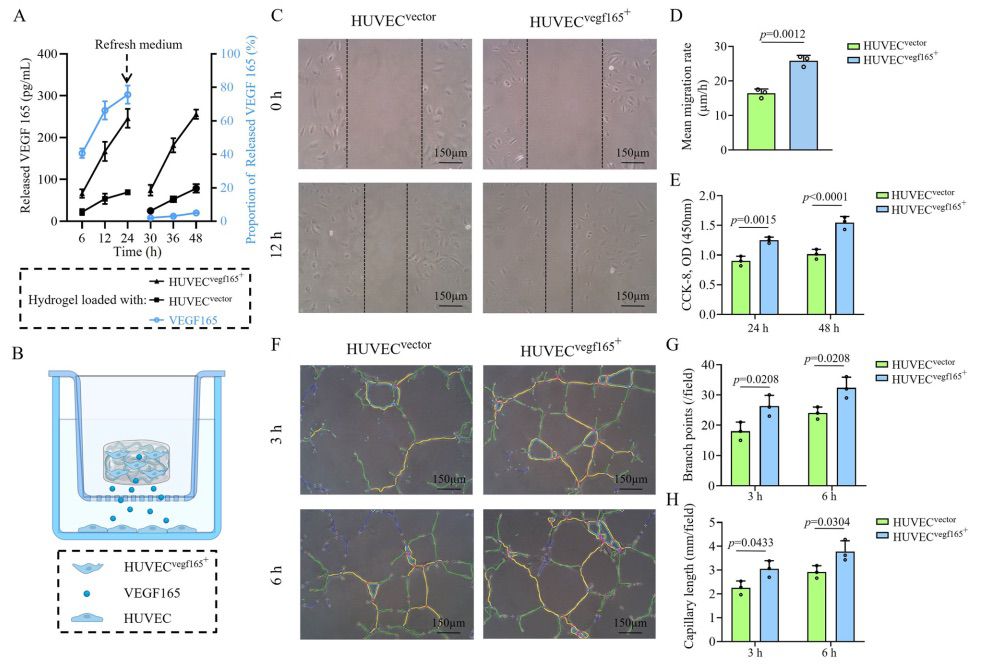
由于 DM 总是伴随着 HG 引起的血管内皮细胞损伤,本研究进一步关注了 HUVECsvegf165+ 水凝胶对 HG 诱导的细胞损伤的影响。图 6A 显示,HG(尤其是 40 mM 的浓度)可导致 HUVEC 死亡。而在 5 mM 葡萄糖和 35 mM D-mannitol 的渗透压控制下,细胞活力并没有受到影响。然后,本研究收集了HUVECsvegf165+负载水凝胶和HUVECvector负载水凝胶的细胞上清液,并将葡萄糖浓度调整为40 mM来处理HUVEC(图6B)。结果表明,HUVECsvegf165+负载的水凝胶释放的较高数量的 VEGF 165 缓解了 HG 诱导的细胞死亡(图 6C),并减少了细胞氧化应激引发的活性氧(ROS)产生(图 6D)。
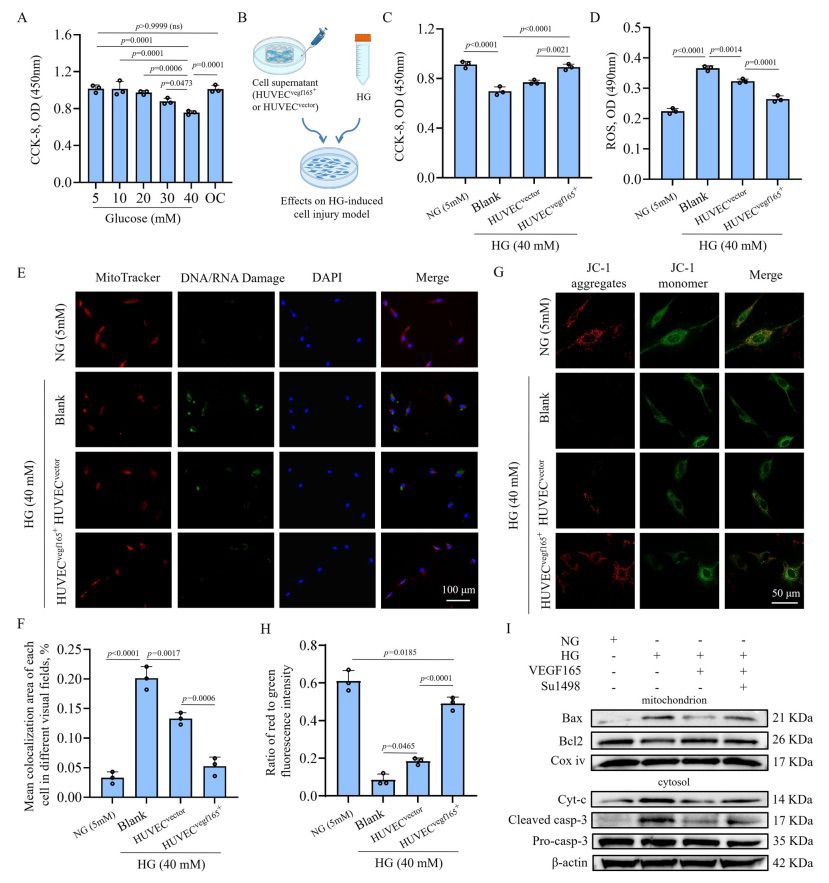
【含有 HUVECsvegf165+ 的水凝胶可促进大鼠糖尿病伤口的愈合】
本研究按照图 7A 所示的实验方案评估了 HUVECsvegf165+ 水凝胶对大鼠糖尿病伤口的治疗效果。大鼠糖尿病伤口模型的建立是通过腹腔注射 70 mg/kg 剂量的链脲佐菌素(STZ),然后手术切除直径 1 厘米的全厚皮肤。与未注射 STZ 的正常对照组大鼠相比,DM 模型在整个实验过程中表现为血糖升高、体重增长迟缓和耗水量增加。水凝胶组、含有 HUVECvector 的水凝胶组和含有 HUVECsvegf165+ 的水凝胶组的 DM 三项指标均无显著差异。第 3 天、第 7 天、第 14 天和第 21 天是采集组织的时间点,对应于伤口修复的炎症、增殖和组织重塑阶段61。基于 DLP 打印技术,水凝胶可根据伤口的不规则形状进行定制(附图 9A),并实现高产率。不同组的伤口愈合过程如图 7B 所示,并在图 7C 中再现。与使用水凝胶或含有 HUVECsvegf165+ 的水凝胶治疗的大鼠相比,含有 HUVECsvegf165+ 的水凝胶组大鼠的伤口闭合速度更快(图 7D)。所有组的水凝胶都在第 21 天前逐渐降解(图 7E)。细胞负载水凝胶中的 VEGF 165 呈再生状态,尤其是前四天的 HUVECsvegf165+ 水凝胶组(图 7F)。与体外研究结果一致,体内 HUVECsvegf165+ 水凝胶比 HUVECvector 水凝胶产生更多的 VEGF 165。这意味着含有 HUVECsvegf165+ 的水凝胶是血管生成和伤口愈合所需的血管内皮生长因子 165 的良好来源。
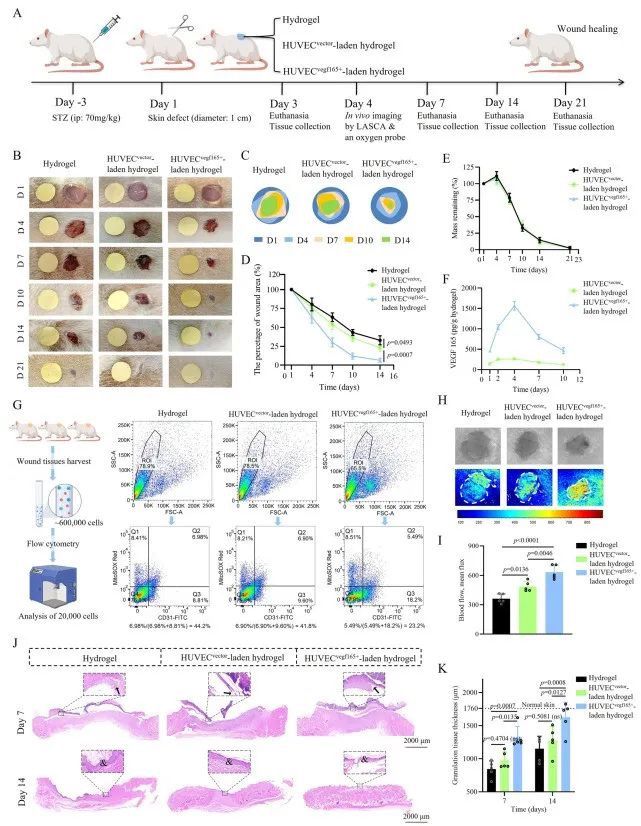
【含有 HUVECsvegf165+ 的水凝胶可促进糖尿病伤口的上皮化、毛发形成、无疤痕趋势、血管生成、细胞增殖和新陈代谢】
为了全面描述伤口愈合状态,本研究进一步应用了多种组织染色技术。再上皮化对伤口愈合非常重要。本研究使用基底角质细胞的标记细胞角蛋白 14(CK14)和棘层角质细胞的标记细胞角蛋白 10(CK10)来评估第 7 天和第 14 天的再上皮化情况。如图 8A 所示,由于上皮层厚度远远超过正常皮肤的上皮层厚度,上皮层侵占了伤口床,并表现出很强的增殖能力。特别是在第 7 天,HUVECsvegf165+负载水凝胶组的扩展上皮层厚度大于单纯水凝胶组或 HUVECvector-负载水凝胶组,这表明 HUVECsvegf165+负载水凝胶早期激活了再上皮化。相比之下,在第 14 天,HUVECsvegf165+-负载水凝胶组的扩展上皮层厚度最小,与正常皮肤相似,表明该组上皮增殖到重塑的进展迅速。此外,第 7 天和第 14 天,表皮基底层毛囊的 K14 染色显示,与水凝胶处理组和 HUVECsvegf165+负载水凝胶组相比,HUVECsvegf165+负载水凝胶组的毛囊密度显著增加(图 8B)。这些结果表明,VEGF 165 的增强和自我更新释放可有效加速角质细胞迁移和毛囊形成,从而促进糖尿病伤口的再上皮化。
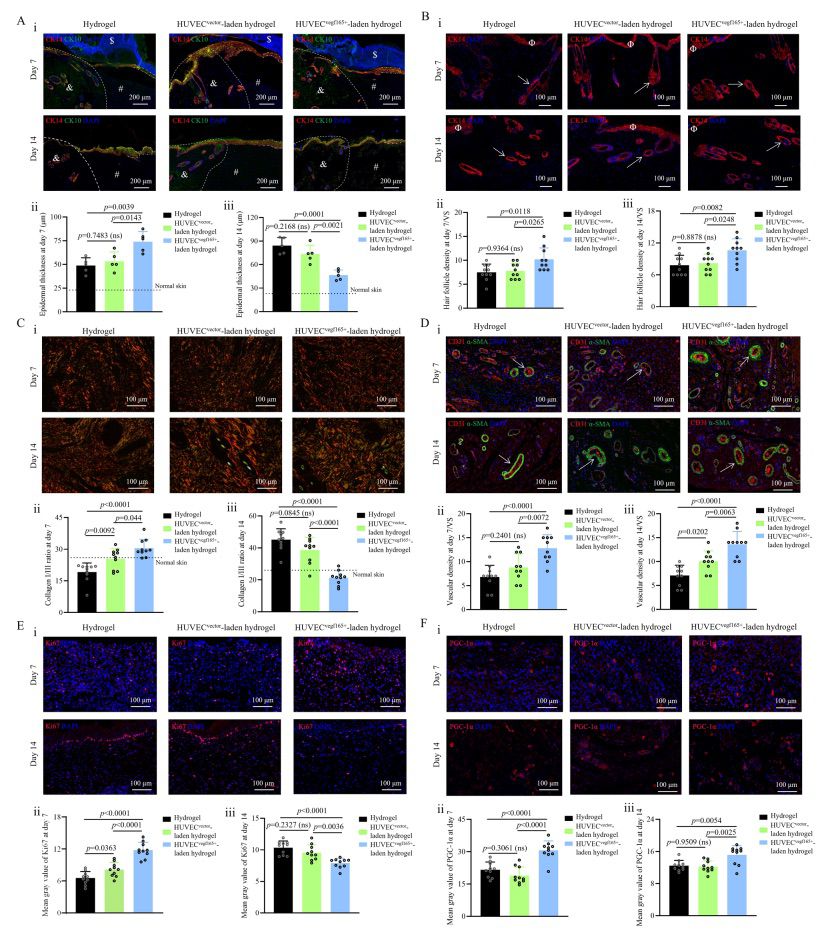
【蛋白质组学发现,HUVECsvegf165+负载水凝胶改善糖尿病伤口愈合的效果与组织血管化和氧合、细胞外基质(ECM)重塑和炎症调节有关】
为了概述增强的、可自我更新的 VEGF 165 刺激所导致的分子信号变化,本研究进一步对使用 HUVECsvegf165+ 水凝胶处理后第 7 天的糖尿病伤口进行了蛋白质组学检测。HUVECsvegf165+ 水凝胶组作为对照组。总的来说,HUVECsvegf165+负载水凝胶组和 HUVECvector负载水凝胶组之间有 500 个蛋白质明显上调,546 个蛋白质明显下调(图 9A)。图 9B 显示了基于主成分分析(PCA)的两组蛋白质表达差异,表明 HUVECs 过表达的 VEGF 165 在调节伤口修复过程中发挥了重要作用。图 9C 中的火山图显示了差异表达的蛋白质。用相应基因名称标记的上调蛋白与血管的发育、形成和增大(如 Clic4、Eng、Enpep、Icam1、Itga1、Tgfbi、Cav1 和 LOC108348074)、ECM 的增加(如 Efemp2、Col12a1、Lama4 和 Lama5)以及细胞粘附性的增强(如 Vcan、Sdc4、Itgb1 和 Icam1)有关。下调的蛋白质与炎症标志物的减少有关。本研究根据差异表达蛋白进一步进行了功能富集分析,以揭示受 HUVECsvegf165+ 水凝胶影响的主要分子通路。从上调蛋白的生物过程富集分析(图 9D)可以看出,HUVECsvegf165+-负载的水凝胶显著促进了 ECM 的组装和组织、动脉形态发生和内皮细胞增殖。在下调蛋白的生物过程富集分析中(图 9E),HUVECsvegf165+负载的水凝胶明显抑制了白细胞聚集和活化、中性粒细胞介导的免疫和 TNF 的产生。
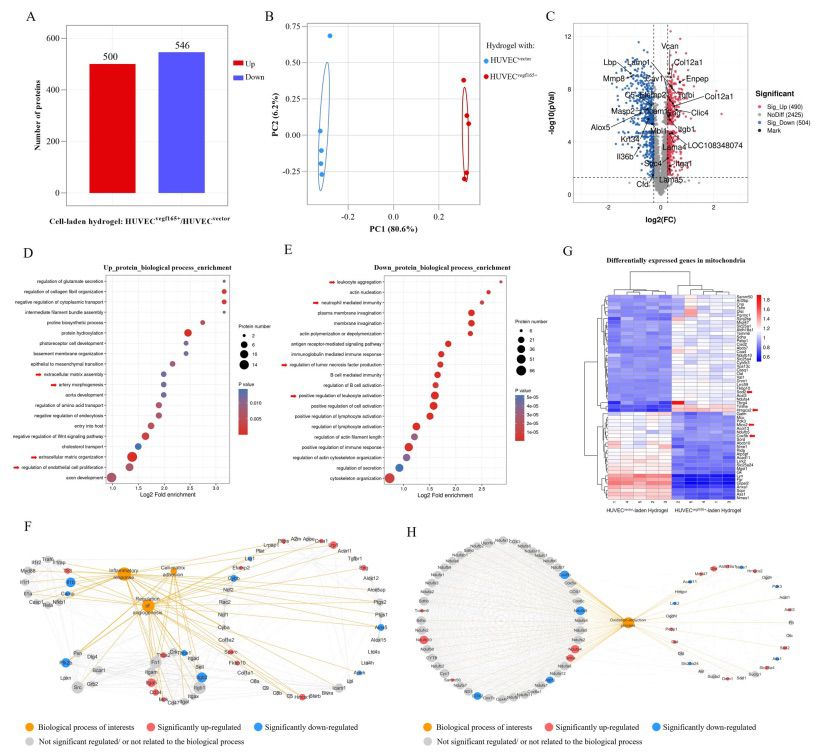
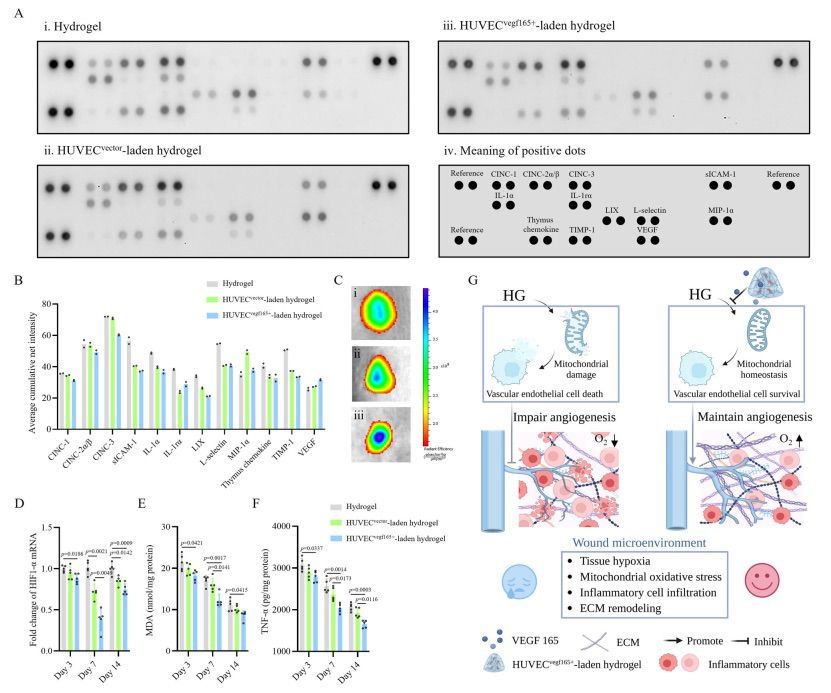
据报道,早期消除炎症有利于无疤痕修复和伤口愈合。为了进一步证实 HUVECsvegf165+ 水凝胶能减少炎症这一发现,本研究在第 7 天评估了糖尿病伤口中的促炎细胞因子和趋化细胞因子。如图 10A 和图 10B 所示,与水凝胶组和 HUVECsvegf165+水凝胶组相比,蛋白质组剖析大鼠细胞因子阵列显示,HUVECsvegf165+-负载水凝胶组的各种促炎和趋化细胞因子,如 CINC-1、CINC-2ɑ/β、CINC-3、IL-1ɑ 和 LIX 的表达均有所下降。此外,在负载 HUVECsvegf165+ 的水凝胶组中,金属蛋白酶抑制剂-1(TIMP-1)的表达低于其他两组,而金属蛋白酶抑制剂-1 能使金属蛋白酶-9 失活,阻碍组织重塑并促进增生性瘢痕的形成。这支持了组织学分析结果,即HUVECsvegf165+ 水凝胶可促进组织重塑并降低疤痕风险。由于 HUVECsvegf165+ 水凝胶的产生,糖尿病伤口的 VEGF 水平升高。血管的形成为氧合提供了氧气传输管道,而氧合是决定组织缺氧、炎症和伤口愈合率的关键因素。因此,本研究在第 4 天使用发光氧探针--三(4,7-二苯基-1,10-菲罗啉)二氯化钌(II)络合物来测量糖尿病伤口的氧合情况。如图 10C 所示,HUVECsvegf165+-负载水凝胶组的氧信号更强,这表明水凝胶持续释放 VEGF 165 改善了伤口氧合。相应地,低氧诱导因子-1ɑ(HIF-1ɑ)是氧张力的指标,在整个伤口愈合过程中,HUVECsvegf165+负载水凝胶组的转录水平较低(图 10D)。
2. 总结与展望
根据本研究结果,HUVECsvegf165+负载的水凝胶是处理糖尿病伤口的有效活体材料。然而,打印分辨率和大鼠模型还存在局限性。提高打印分辨率的潜在方法包括提高光源分辨率或添加特定生物大分子以抑制光引发过程中未暴露区域的自由基聚合。此外,通过注射 STZ 制作的大鼠糖尿病伤口模型仅代表了人体复杂的糖尿病伤口病理生理学的一部分;因此,还需要在大型哺乳动物或患者身上进行更多试验,以验证治疗效果并确定具体用法。
文章来源:
https://www.nature.com/articles/s41467-023-43364-2




0 留言